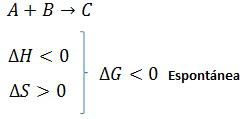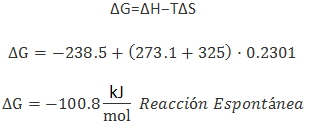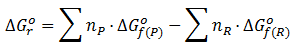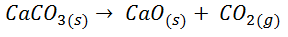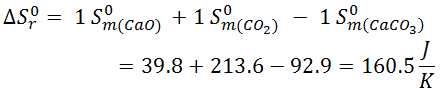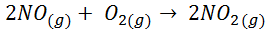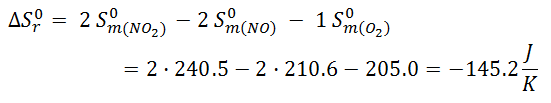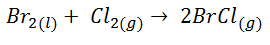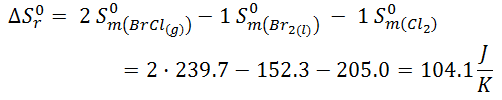3. Termoquímica
4. Equilibrio Químico
En esta página encontrarás vídeos sobre toda la teoría de Equilibrio Químico y como numerosos ejercicios resueltos, muy bien explicados por nuestra profesora.
Article 2
Termodinámica Ejercicio 31: Determinar qué sustancia tiene mayor entropía molar estándar
En este ejercicio vamos a determinar de forma cualitativa cuál de cada par de sustancias se espera que tenga un mayor valor de entropía molar estándar. La entropía molar estándar es el valor de entropía de cada sustancia en condiciones termodinámicas estándar, es decir, a 25ºC y 1 atmósfera para 1 mol de sustancia. Las unidades de la entropía molar estándar son J/mol·K.
Para poder determinar cualitativamente cuál de dos sustancias tendrá un mayor valor de entropía molar estándar, debemos recordar algunos criterios que hemos establecido en el vídeo de teoría número 18 de termoquímica, relativo al Tercer Principio de la Termodinámica, como por ejemplo:
- La entropía de los gases es mayor que la de los líquidos, y la de estos mayor que la de los sólidos.
- En el caso de sustancias con el mismo estado de agregación y similar masa atómica, tendrá mayor entropía la que tenga un mayor número de átomos, por ejemplo, en el caso del etano y del monóxido de nitrógen, ambos con masa molecular 30 g/mol, el etano tiene una mayor entropía molar estándar (229,5 J/K·mol frente a los 210,6 J/K·mol del NO) por tener mayor número de átomos.
- Cuanto más débiles son los enlaces entre los átomos que forman una especie química, mayor es la entropía. Por ejemplo, en el caso del etano, el eteno y el etino (compuestos orgánicos de 2 carbonos con enlace simple, doble y triple respectivamente), el etano es el que tiene una mayor entropía molar porque el enlace simple carbono-carbono es más débil que el enlace doble y este a su vez que el triple.
Según establece el Tercer Principio de la Termodinámica, la entropía es cero para un sólido cristalino perfectamente ordenado en el cero absoluto, y va aumentando a medida que aumenta la temperatura y se incrementan con ésta los movimientos moleculares (a mayor temperatura, mayor entropía). Este es el motivo de que todas las sustancias tengan valores de entropía absolutos y positivos, porque tenemos una escala real que empieza en cero y va en aumento. En la tablas de entropía no hallamos incrementos o variaciones de entropía sino simplemente valores absolutos de entropías, S. Como la escala de entropía tiene este cero real, la entropía de los elementos puros no es cero, sino que tiene su correspondiente valor dado.
El enunciado completo del ejercicio es:
De los siguientes pares de sustancias, razonar cuál es ellas tendrá un mayor valor de entropía molar estándar.
a) C2H2 y C2H6
b) H2O(g) y H2O(l)
c) CO(g) y CH3OH(l)
d) SO2(g) y SO3(g)
También te puede interesar:
TEORÍA:
Termodinámica Teoría 16: Espontaneidad de las reacciones químicas. Concepto de entropía
Termodinámica Teoría 17: Segundo Principio de la Termodinámica. Entropía del Universo
Termodinámica Teoría 18: Tercer Principio de la Termodinámica. Concepto de entropía molar estándar
Termodinámica teoría 22: Cómo predecir la espontaneidad de una reacción química con ΔGr
Hemos visto en el vídeo Termodinámica Teoría 20: Concepto de energía libre de Gibbs que el criterio de espontaneidad y no espontaneidad de una reacción química a partir de ΔG es el siguiente:
| ΔG > 0 | No espontánea |
| ΔG = 0 | Equilibrio |
| ΔG < 0 | Espontánea |
Por tanto, conociendo el valor de ΔG, o simplemente su signo, podemos determinar si la reacción dada es o no espontánea. Ahora bien, ¿cómo podemos llegar al valor de ΔGro? Pues tenemos diferentes opciones, y usaremos una u otra en función de los datos de los que dispongamos.
- Con la fórmula que relaciona H y S (ΔG = ΔH – TΔS (visto en el apartado Termodinámica Teoría 20: Concepto de energía libre de Gibbs))
- De forma cualitativa: solo se determina el signo de ΔG disponiendo de los signos de ΔH y ΔS
![determinacion del signo de la energia libre con signo de H y S determinacion del signo de la energia libre con signo de H y S]()
- De forma cuantitativa: calcular directamente ΔG si disponemos de ΔH, ΔS y T, por ejemplo: si
T = 325ºC
ΔH = -238,5 kJ/mol
ΔS = ±230,1 J/K·mol (hay que pasar los J a kJ)
![Ejemplo calculo de la variacion de energia libre Ejemplo calculo de la variacion de energia libre]()
- De forma cualitativa: solo se determina el signo de ΔG disponiendo de los signos de ΔH y ΔS
- Con la expresión de productos-reactivos, es decir, a partir de las energías libres de formación ( visto en el apartado Termodinámica Teoría 21: Energías libres de Gibbs de formación y de reacción)
![formula del calculo de energia libre de gibbs reaccion con energias libres de formacion simplificada formula del calculo de energia libre de gibbs reaccion con energias libres de formacion simplificada]()
![Ejemplo de calculo de la variacion de energia libre para la formacion de co2 Ejemplo de calculo de la variacion de energia libre para la formacion de co2]()
Termodinámica ejercicio 32: Predecir el signo de la variación de entropía de algunas reacciones químicas
En este ejercicio resuelto del tema de termoquímica vamos a predecir el signo de la variación de la entropía de una serie de procesos a partir de los estados de agregación de los productos y los reactivos que intervienen en dichos procesos. Para ello nos basaremos en lo que hemos visto en el vídeo de Teoría 19.2: Deducción cualitativa del signo de la entropía de reacción.
En primer lugar plantearemos y ajustaremos correctamente la reacción química de cada proceso y seguidamente determinaremos qué sucede en dicha reacción, si aumenta el desorden de reactivos a productos, ΔS>0, o bien si el desorden disminuye de reactivos a productos, ΔS<0.
El enunciado completo del ejercicio y su explicación escrita es:
Justificar el signo que cabe esperar para ΔS de los procesos siguientes:
a) Obtención de cloruro de litio a partir de litio sólido y Cl2
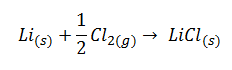
En este caso, tal y como explicaremos con detenimiento en el vídeo, el desorden disminuye, ΔS<0, ya que la entropía de los reactivos es mayor que la de los productos, pues el Cl2 se encuentra en estado gaseoso. Ya hemos visto en los correspondientes apartados de teoría que los gases tienen mayor desorden que los sólidos.
b) Sublimación del yodo

Para la reacción de sublimación del yodo, la entropía aumentará, ΔS>0, ya que pasamos de un sólido que es ordenado a un gas que es altamente desordenado. De hecho, siempre que tengamos un cambio de estado de sólido a gas podemos decir que el desorden aumenta. Para las condensaciones o solidificaciones pasa exactamente lo contrario, el desorden disminuye, ΔS<0.
c) Formación de amoniaco a partid de N2 y H2

Como todos los elementos son gases, podemos decir que ambos sistemas son altamente desordenados. Por ello, para determinar el signo de la ΔS lo que vamos hacer es calcular Δn, es decir, la variación del número de moles. De este modo podemos determinar si la entropía aumenta o disminuye siguiendo las siguientes pautas:
Si aumenta el número de moles, Δn>0, la entropía también aumenta.
Si el número de moles disminuye, Δn<0, también lo hará la entropía.
Así, para el caso de la formación de amoníaco aquí planteado, tal y como veremos con detenimiento en el vídeo, ocurre que:

Como Δn<0, tenemos que ΔS<0. El desorden disminuye, ya que pasamos de un mayor número de moles gaseosos en los reactivos a un número menor de moles gaseosos en los productos.
d) Descomposición de yoduro de hidrógeno para dar yodo e hidrógeno.

Este apartado lo realizaremos igual que en el apartado anterior:

Como en este caso tenemos que Δn=0, podemos decir que nuestra variación de entropía es muy pequeña, casi despreciable. Aunque siempre hay una pequeña variación, indicaremos que ΔS ≃ 0, es decir, la entropía prácticamente no variará, o al menos no podemos determinarlo de forma cualitativa.
e) Disolución de cloruro de sódico en agua

Tal y como hemos visto en el apartado de teoría, para la disolución de cualquier sal iónica la entropía aumenta, ΔS>0.
También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Termodinámica ejercicio 33: Cálculo de la entropía de reacción con entropías molares estándar
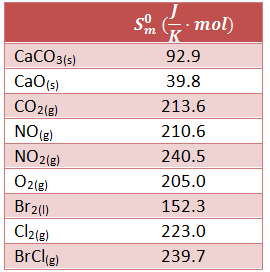
En este ejercicio resuelto del tema de termoquímica calcularemos la variación de entropía de algunas reacciones. El enunciado completo es el siguiente:
Calcular la variación de entropía de las siguientes reacciones a partir de las entropías molares estándar de los compuestos de las sustancias que intervienen en las mismas.
- Descomposición térmica del carbonato cálcico
- Creación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno
- Cloruro de bromo a partir de bromo y cloro
Disponemos de los datos en la siguiente tabla, donde nos indican las entropías molares estándar de las sustancias que intervienen en los 3 apartados. Vamos a realizar el cálculo utilizando la fórmula explicada en el vídeo de teoría Termodinámica Teoría 19.1: Cómo calcular la variación de entropía de una reacción con las entropías molares estándar.
En este caso, la fórmula a utilizar será la siguiente:
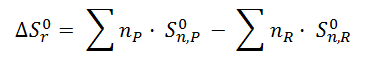
Como se puede observar es una fórmula muy parecida, ya utilizada en apartados anteriores, a la fórmula del cálculo de la variación de entalpía de una reacción a partir de las entalpías de formación. Las principales diferencias entre la fórmula de entropía y entalpía es que para la entropía no existe el símbolo griego delta, Δ, ya que en la tabla aparecen valores absolutos de entropía y no variaciones. Además, para el caso de las entropías molares estándar las entropías de los elementos no son cero.
Veamos la resolución escrita del ejercicio que se resuelve y explica paso a paso en el vídeo:
![Fórmula descomposición térmica del carbonato cálcico y cálculo entropía Fórmula descomposición térmica del carbonato cálcico y cálculo entropía]()
![Resolución entropías descomposición térmica del carbonato cálcico Resolución entropías descomposición térmica del carbonato cálcico]()
Como ΔS > 0, significa que aumenta el desorden, lo cual es normal, ya que pasamos de tener un sólido, altamente ordenado, a tener un sólido y un gas, este último completamente desordenado.
![Fórmula formación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno Fórmula formación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno]()
![Resolución entropía creación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno Resolución entropía creación de dióxido de nitrógeno a partir de monóxido de nitrógeno y oxígeno]()
En este caso ΔS < 0, lo cual quiere decir que ha disminuido el desorden. Es lógico, ya que inicialmente había 3 moles de reactivos y, cuando la reacción se lleva a cabo, sólo hay 2 moles de productos. Como el número de moles de gas ha disminuido el desorden también disminuye.
![Fórmula cloruro de bromo a partir de bromo y cloro Fórmula cloruro de bromo a partir de bromo y cloro]()
![Resolución entropía cloruro de bromo a partir de bromo y cloro Resolución entropía cloruro de bromo a partir de bromo y cloro]()
En este caso la variación de entropía aumenta, ya que tenemos dos moles de producto en forma gaseosa, mientras que tenemos un mol en forma líquida y un mol en forma de gas en los reactivos. Por lo tanto, como hay un mayor número de moles en forma de gas en el producto, es lógico que le desorden haya aumentado y que ΔS < 0.
También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Un polímero sorprendente con nombre de fruta: el melón
En demasiadas ocasiones hay personas que piensan (imagino que porque los químicos no hemos sabido transmitirles lo contrario) que ser químico consiste únicamente en saber de memoria el nombre de un montón de compuestos, formularlos del derecho y del revés o pintarrajearlos en un papel; muchos de ellos aderezan esta creencia con una imagen mental de inmenso tedio y resoples varios. No voy a detenerme ahora a analizar qué es y qué no es ser químico, ya habrá ocasión más adelante. Tan solo quiero resaltar que yo misma, por mucho que tenga la carrera de química (y aunque tuviese tres doctorados) no me sé todos lo compuestos del mundo (¡hay millones!) y que a veces también me sorprendo ante un compuesto nuevo, uno que no conocía, por inusual, remoto por estar fuera de mi campo de estudio o simplemente por su nombre peculiar.
Porque hasta hoy, para mí, un melón era un melón… ¿Y qué es un melón? ¡Pues una fruta!, ¿no? Sí, eso pensaba yo también. Hasta que he descubierto que hay un compuesto que se llama melón. Y es que andaba yo vagabundeando por una entrada de Wikipedia, la de las heptacinas, y leo lo siguiente: “El compuesto que tiene tres sustituyentes amino se denomina melem (tris-triazina). Cuando la heptacina se polimeriza mediante el enlace de las unidades de tris-triazina a través del grupo amino, el compuesto recibe el nombre de melón. El otro homólogo de la melamina [...] es el dímero melam”. Y aquí me tenéis, boquiabierta, pensando que esto más bien parece un trabalenguas: melam, melem y melón.
Y resulta que estas sustancias son verdaderamente interesantes. Para empezar, no son solubles en ningún disolvente. Ninguno. Ni polar, ni apolar. Son algo así como moléculas autistas. Esta es la estructura general de las heptacinas, que son derivadas de la melamina:

Estructura general de una heptacina con tres sustituyentes alquilo, R1, R2 y R3, que pueden ser iguales o distintos entre sí. Ciertamente, la perfección de su estructura resulta fascinante. Fuente: wikipedia
Como vemos, una heptacina es un compuesto químico que consiste en un grupo triangular de tres anillos de triacina. Variaciones de esta estructura y de la melamina dan lugar a los otros compuestos. Por ejemplo, este es el melam, que no es una heptacina propiamente dicha:

Estructura del melam. Fuente: wikipedia.
Si los tres grupos R de la heptacina son grupos amino, -NH2, entonces tenemos el melem:

Estructura del melem
Y si el melem polimeriza a través de sus grupos amino, dando lugar a aminas secundarias y terciarias que unen los distintos monómeros de heptacinas, entonces se obtiene el susodicho. Este pequeño fragmento de polímero, formado por tres unidades, es un ejemplo de el melón (y no un melón):

Tres monómeros de melem, tris-s-triacina, unidos entre sí por sus grupos amino. La repetición de esta unidad básica da lugar a polímeros de propiedades muy interesantes, denominados melón. Fuente: Nature
La red continúa, dando lugar a una estructura de láminas poliméricas similar a la estructura de una lámina de grafito, por lo que se puede decir que es un material grafitoide.

Hoja grafitoide del polímero melón
La diferencia esencial es que en el grafito no quedan huecos, mientras que sí que hay huecos en las láminas del melón. Esto hace que sea un material más poroso que pueda tener aplicaciones, o sobre ello se investiga, para la producción catalítica y almacenamiento de hidrógeno a partir de agua (es decir, aplicaciones energéticas muy importantes).

Huecos presentes en la hoja grafitoide del polímero melón
La producción de hidrógeno a partir de agua usando polímeros catalizadores y energía solar es una fuente de energía futura ideal, independiente de las reservas fósiles. Los catalizadores deben ser suficientemente eficientes, estables y no demasiado caros, características que estos polímeros de nitrógeno y carbono, como el melón, parecen cumplir. Contrariamente a lo que ocurre con otros polímeros semiconductores, estos son también térmicamente estables y no son especialmente complejos de sintetizar. Es un paso hacia una especie de fotosíntesis sintética en la que los polímeros semiconductores se podrán utilizar como transductores.
Como veis, la química, por muy “químicos” que seamos, nunca deja de sorprendernos.
Más información:
Artículo de Nature sobre la polimerización del melem y sus características: http://www.nature.com/nmat/journal/v8/n1/pdf/nmat2317.pdf
Artículo en wikipedia sobre las heptacinas
Nota: Esta entrada participa en el XXVII Carnaval de Química, alojado en la web Educación Química.
Termodinámica ejercicio 34: Calcular energías libres de reacción a partir de energías libres de formación
En este ejercicio resuelto de termoquímica vamos a calcular la energía libre de reacción de una serie de reacciones químicas. El enunciado completo es el siguiente:
Calcular la ΔGr de las reacciones siguientes, a partir de las libres de formación que se indican. Deducir también, en base al resultado, si las reacciones serán espontáneas o no espontáneas:
a.

b.

c.

También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Ejercicio 33 termoquímica: cálculo de la entropía de reacción con entropías molares estándar
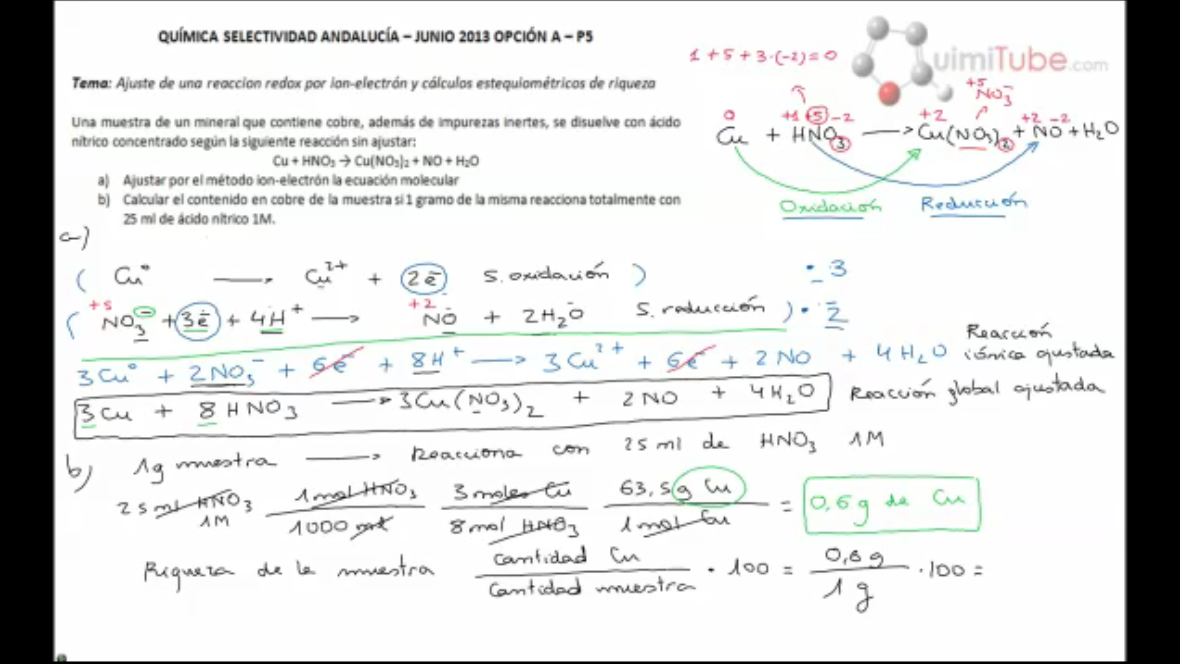
Ejercicio de selectividad (junio 2013, Andalucía): redox del cobre y el ácido nítrico y estequiometría posterior
En este vídeo vamos a resolver un ejercicio de química de Selectividad de Andalucía, de la convocatoria de junio de 2013; en concreto, se trata del ejercicio 5 de la opción A. El enunciado completo es el siguiente:
Una muestra de un mineral que contiene cobre, además de impurezas inertes, se disuelve con ácido nítrico concentrado según la siguiente reacción sin ajustar:
Cu + HNO3 -> Cu(NO3)2 + NO + H2O
a) Ajustar por el método del ion-electrón la ecuación molecular.
b) Calcular el contenido en cobre de la muestra si 1 gramo de la misma reacciona totalmente con 25 ml de ácido nítrico 1M.
Por tanto, en primer lugar, vamos a ajustar la reacción. Para ello debemos averiguar primero los estados de oxidación de los distintos elementos que intervienen en la reacción; de este modo, sabremos que el elemento que se oxida es aquel cuyo estado de oxidación aumenta, y el elemento que se reduce aquel cuyo estado de oxidación disminuya. Como veremos con detenimiento, el cobre pasa de un estado de oxidación 0 a un estado de oxidación +2, por lo que se está oxidando; el nitrógeno pasa de un estado de oxidación +5 a un estado de oxidación +2, por lo que se está reduciendo.
Una vez ajustada la reacción, realizaremos unos cálculos estequiométricos muy sencillos en base a ella para determinar el contenido total en cobre de una muestra de 1 gramo. Debemos tener en cuenta que la masa total de la muestra no se empleará en el cálculo estequiométrico, ya que además de cobre contiene otras sustancias inertes; únicamente la emplearíamos si nos pidieran la riqueza, la cual nosotros calcularemos a modo de ejemplo, pero en el enunciado de selectividad no nos están pidiendo calcularla.
Termodinámica ejercicio 35: Determinar el signo de la energía libre con entalpía y entropía
En este ejercicio resuelto del tema de termoquímica vamos a determinar el signo de la energía libre de Gibbs sabiendo el signo de la variación de entalpía y de la variación de entropía de una serie de reacciones químicas. El enunciado completo es el siguiente:
Dado el signo de la variación de entalpía, ΔH, y de la variación de entropía, ΔS, para las reacciones siguientes, determinar cualitativamente si serán espontáneas o no espontáneas y a qué temperatura.
a) Reacción de combustión del propano:

b) Reacción de fotosíntesis: formación de glucosa y oxígeno a partir de dióxido de carbono, agua y energía luminosa:

c) Reacción de formación de amoníaco gaseoso a partir de nitrógeno e hidrógeno:

También te puede interesar:
Ejercicio 31 termoquímica: determinar qué sustancia tiene mayor entropía molar estándar
Ejercicio 33 termoquímica: cálculo de la entropía de reacción con entropías molares estándar
Ejercicio de Selectividad (septiembre 2013, Andalucía): fórmula empírica y molecular de un hidrocarburo
En este vídeo vamos a resolver un ejercicio de Selectividad de la comunidad autónoma de Andalucía, de la convocatoria de septiembre de 2013; en concreto, se trata del ejercicio 5 de la opción A. El enunciado completo es el siguiente:
a) Determine la fórmula empírica de un hidrocarburo sabiendo que cuando se quema cierta cantidad de compuesto se forman 3,035 g de CO2 y 0,621 g de agua.
b) Establezca su fórmula molecular si 0,649 g del compuesto en estado gaseoso ocupan 254,3 ml a 100 ºC y 760 mm de Hg.
Para realizar el ejercicio, en primer lugar recordaremos qué se entiende por fórmula empírica y por fórmula molecular de un compuesto. Así:
La fórmula empírica da la relación mínima entre los átomos que forman la sustancia.
La fórmula molecular establece el número real de átomos en las moléculas.
En primer lugar determinaremos la fórmula empírica del compuesto. En el vídeo lo resolvemos considerando que el hidrocarburo tendrá una fórmula genérica CxHy. Una vez determinada la fórmula empírica, sabiendo el volumen ocupado por una cierta cantidad del compuesto, 0,649 g, en ciertas condiciones de presión y temperatura, podremos aplicar la fórmula de los gases ideales, P·V = n·R·T, para determinar su masa molecular. La masa molecular nos llevará a la determinación de la fórmula molecular del compuesto, que en este caso es C6H6, benceno.
¿Por qué no se deben mezclar el salfumán y la lejía?
En esta entrada vamos a hablar de una reacción química que puede ocurrir de forma cotidiana y con sustancias que tenemos habitualmente en casa, a pesar de que es muy peligrosa. Es posible que hayáis oído en múltiples ocasiones la advertencia de: “nunca mezclar lejía con salfumán“. Se suele repetir en a menudo durante los cursos de prevención de riesgos laborales para puestos de trabajos que manejan productos de limpieza, y también viene indicado en la etiqueta de estas sustancias.
Aquí vemos las indicaciones de precaución que aparecen en una botella de salfumán:

Y aquí las indicaciones de precaución que aparecen en una botella de lejía:

En efecto, vemos que en la etiqueta del salfumán se indica específicamente que no debe mezclarse con lejía ni con amoníaco porque se pueden producir gases peligrosos. Asimismo, en la etiqueta de la lejía, se indica que no debe mezclarse con ácidos. El salfumán es un ácido fuerte, concretamente se trata de ácido clorhídrico, HCl, con una concentración que suele oscilar entre el 16 y el 20%. Es por este motivo, porque el salfumán es un ácido, que no se puede mezclar con la lejía, ya que en medio ácido se puede producir una reacción química en la que se libera cloro gaseoso.
La mezcla de lejía con salfumán produce gas cloro, sumamente tóxico y peligroso.
¿Cuál es esta reacción? Bueno, la lejía es una disolución diluida (en torno al 5%) de hipoclorito sódico, NaClO. Los aniones hipoclorito, ClO-, junto con los aniones cloruro, Cl-, sufren la siguiente reacción en medio ácido:

, liberando cloro y formando agua. Vemos que se trata de un equilibrio químico; según el principio de Le Châtelier, el aumento de la concentración de protones (es decir, la disminución del pH) favorece el desplazamiento del equilibrio hacia la derecha y por tanto la liberación de gas cloro. Puesto que el salfumán es una disolución al 20% de HCl tendrá un pH bastante bajo, lo cual favorecerá la formación del peligroso compuesto que, además, se desprenderá a la atmósfera, continuando así con el desplazamiento del equilibrio de forma constante. Esto hace que la liberación de Cl2 en la reacción sea bastante rápida.
En concreto, se trata de una reacción de oxidación-reducción, ya que hay cambio en los números de oxidación de los compuestos que intervienen.
El cloro del hipoclorito pasa de un estado de oxidación +1 a un estado de oxidación 0 en el Cl2. Esto significa que se ha reducido, actuando como oxidante, porque su estado de oxidación disminuye.

Por su parte, el cloro del cloruro, Cl-, pasa de un estado de oxidación -1 a un estado de oxidación 0 en el Cl2. Esto significa que se ha oxidado, actuando como reductor, porque su estado de oxidación aumenta.

El cloro diatómico producido, Cl2, es un compuesto sumamente tóxico que puede llegar a producir la muerte (puedes ver un ejemplo de sus terribles consecuencias aquí, y más información sobre su toxicidad, efectos y precaución de manejo aquí). De hecho, ha sido incluso usado como arma química en algunas guerras a lo largo de la historia.
Para mostrar esta reacción química de una forma más visual, os dejamos con este vídeo sobre la misma (está en catalán, pero subtitulado en castellano para quien no lo entienda). Resulta muy interesante, ya que utilizan el gas cloro producido en la reacción de lejía con salfumán para decolorar una flor (y dejarla un poquito chuchurrida, la pobre):
También te puede interesar:
Salvando a los crash test dummies: la química del airbag
¿En qué se diferencian la gasolina 95 de la 98?
¿Qué cantidad de almendras amargas hay que ingerir para morir envenenado?
Atracones navideños: una ayuda química para la acidez estomacal.
¿Qué compuesto tiene el menor intervalo líquido?
Todo compuesto químico tiene una serie de propiedades físicas que lo caracterizan. Algunas de las propiedades físicas más importantes, debido a que delimitan de una forma determinante el uso que se le puede dar a una sustancia, son los puntos de fusión y ebullición, es decir, el estado físico en el que un compuesto se encuentra a una determinada temperatura.
El punto de fusión de una sustancia es la temperatura a la cual pasa del estado sólido al estado líquido a una presión determinada; generalmente, se considera una presión estándar de 1 atmósfera.
El punto de ebullición de una sustancia es la temperatura a la cual pasa del estado líquido al estado gaseoso a una presión determinada; generalmente, se considera una presión estándar de 1 atmósfera.
Ejemplos de la importancia del estado físico lo encontramos en todos los compuestos que se utilizan en nuestra vida cotidiana, pero muy especialmente, por ejemplo, en el agua (que sea líquida y además en un intervalo de temperaturas muy amplio fue y es determinante para la vida); o en el oxígeno, que es un gas y ocupa la totalidad de nuestra atmósfera, lo que hace que lo podamos inhalar con facilidad para utilizarlo como oxidante en la cadena respiratoria.
Considerando esto, los puntos de fusión y de ebullición de las sustancias, hoy centraremos en una curiosidad: ¿cuál es el compuesto que tiene un intervalo más pequeño en el que se encuentra en estado líquido? Este honor corresponde al tetrafluoruro de silicio, SiF4, cuyos puntos de fusión y ebullición son:
Punto de fusión: -90ºC
Punto de ebullición: -86ºC
Intervalo líquido: 4ºC

Modelo molecular del tetrafluoruro de silicio. Fuente: Wikipedia.
Como vemos, tan solo permanece en estado líquido en un intervalo de 4ºC. Por debajo de -90ºC estará en estado sólido, y por encima de -86ºC estará en estado gaseoso.
Resulta curioso, especialmente si lo comparamos con otros compuestos similares, como pueden ser:
Tetrafluoruro de carbono, CF4
Punto de fusión: -184ºC
Punto de ebullición: -128ºC
Intervalo líquido: 56ºC
Modelo molecular del tetrafluoruro de carbono. Fuente: Wikipedia.
Tetracloruro de silicio, SiCl4
Punto de fusión: -69ºC
Punto de ebullición: 58ºC
Intervalo líquido: 127ºC
Como podemos ver, a pesar de la aparente similitud en la geometría y composición de estos compuestos, sus propiedades son radicalmente distintas.
La circonita: el diamante de los pobres
El diamante es una de las gemas más apreciadas en joyería. Aparece frecuentemente a lo largo de la historia y de la literatura, asociado a la codicia, al lujo o a la realeza; y es que pocas piedras preciosas tienen un brillo y una pureza tan subyugadoras, como se puede apreciar en la siguiente imagen:
Pero… esperad un momento… ¿seguro que lo que se observa en esa foto es un diamante? Pues lo cierto es que no. Se trata de circonita (o zirconita), una gema con propiedades macroscópicas muy similares a las del diamante, pero muchísimo más barata, por lo que a menudo se le denomina “diamante de imitación” o, más comúnmente, el “diamante de los pobres”.
La circonita es una de las formas del óxido de circonio, ZrO2; en concreto, se trata de la forma cristalina cúbica. Este mineral se produce de forma sintética en un proceso de bajo coste. Además, es duradero, presenta elevada dureza (un valor de 8 en la escala de Mohs, aunque el diamante presenta una dureza de 10) y, como hemos visto en la imagen, su semejanza con el diamante es bastante considerable. Por estos motivos, su similitud y su bajo coste, se ha convertido en el principal competidor industrial de este último. Desde que comenzó a sintetizarse, en la década de los 70, se producen anualmente varios centenares de toneladas de circonita.
Aunque el óxido de circonio existe también en forma natural como el mineral baddeleyita, la similitud que presentan el zirconio y el hafnio hace que este mineral presente, en la práctica, una gran cantidad de óxido de hafnio impurificando al óxido de circonio, por lo que ambos óxidos son difícilmente separables. Además, en este mineral, el óxido de circonio se halla cristalizado con estructura monoclínica, y no con estructura cúbica, la requerida para “imitar” al diamante. El proceso de síntesis artificial, sin embargo, permite producir óxido de circonio puro con estructura cristalina cúbica.
A continuación vemos la estructura del óxido de circonio. En rojo se muestran los átomos de oxígeno, menos voluminosos, y en blanco los átomos de circonio.
Dicha estructura presenta una característica que lo asemeja al diamante, y es que ambas estructuras son cristalográficamente isométricas, es decir, en ambos casos la celda unidad de la estructura tiene forma de cubo. Veamos, de hecho, la estructura cristalina del diamante, formada íntegramente por carbonos (unidos entre sí con enlaces covalentes y con hibridación sp3).
Sin embargo, a pesar de su similitud y de sus características deseables, la circonita no es la única gema capaz de competir industrialmente con los diamantes. Otros compuestos, como la moissanita (carburo de silicio, SiC), el rutilo sintético (dióxido de titanio, TiO2) o el titanato de estroncio (SrTiO3) pueden sintetizarse también con propiedades de dispersión óptica y dureza similares a los del diamante, y en los últimos años han ido también ganando terreno como imitadores de categoría. A pesar de esto, un experto con el equipamiento adecuado es capaz de distinguir un diamante puro de uno de imitación mediante una inspección óptica no destructiva; hechos, naturalmente, que a los demás mortales nos pasan desapercibidos (sospecho que a mí me darían gato por liebre).

Y ahora sí, aquí tenéis la imagen de un verdadero diamante, de esos que valen su peso en oro o, bueno, muchísimo más que el oro:
Cómo y por qué votar a Quimitube como Mejor blog educativo en los Premios Bitácoras 2013
Bueno, un año más, llegan los Premios Bitácoras para premiar a los mejores blogs en distintas categorías; ya es la novena edición. Tal vez algunos de vosotros recordéis que el año pasado, sin esperarlo siquiera, en Quimitube.com llegamos a estar entre los 3 blogs finalistas en la categoría de “Mejor blog de educación” gracias a los votos de nuestros usuarios (gracias a vuestros votos).
Finalistas Bitácoras 2012 en la categoría de Mejor blog de educación
El jurado consideró merecedor de premio a otro de los tres finalistas (reiteramos nuestra enhorabuena) pero a nosotros nos quedó el gusanillo reconcomiéndonos. Así que este año, si no os importa, volvemos a hacer un poquito de campaña para ver si podemos “colarnos” nuevamente entre los tres finalistas. De momento, en la segunda clasificación provisional del 15 de octubre, estamos en la posición 14:
Segunda clasificación provisional Bitácoras 2013 en la categoría de Mejor blog de educación
Aún nos faltan bastantes votos para lograrlo. Sin embargo, todavía hay tiempo para votar hasta el 15 de noviembre de 2013 y las cosas aún pueden cambiar (¡esperemos que a mejor!).
Por ello os pedimos un empujoncito, es decir, un voto y la máxima difusión posible.
¿Por qué votar a Quimitube?
Aunque en alguna ocasión hemos hablado del esfuerzo que estamos poniendo en esto, no creo que nuestro esfuerzo os deba condicionar a la hora de votar. Eso es decisión nuestra, no hay por qué premiar un esfuerzo libremente decidido por quien se esfuerza, pero tal vez sí merezcan premio los resultados de ese esfuerzo. Muchos alumnos están aprendiendo química y dejando de verla como un coco, especialmente alumnos que no pueden asistir a clases presenciales y se ven obligados a prepararse por su cuenta.
En cuanto al…
¿Cómo votar a Quimitube?
¡Un poco complicado sí que nos lo han puesto nuestros amigos de Bitácoras! O eso piensan los que no son usuarios registrados, así que hemos elaborado esta entrada didáctica para explicarlo por pasos:
1. Buscar el banner de Bitácoras 2013 “vota ahora” que veis en esta imagen y hacer clic en él. Está en diversos puntos de la web, también a la izquierda de esta misma entrada.

2. Después de clicar en el banner os aparecerá esta pantalla de la web de Bitácoras.com

3. Al clicar en “conectar con Facebook” o “conectar con Twitter” os llevará al inicio de sesión de dichas redes sociales si no habéis hecho login en el mismo navegador. Si habéis hecho login previamente en el navegador, os llevará directamente a vuestro Facebook o a vuestro Twitter.

4. Una vez que hayáis accedido con Facebook o Twitter llegaréis a esta pantalla. Se debe clicar en “Vota ahora”:

5. En la pantalla de votos ya aparecerá directamente “http://www.quimitube.com” en la categoría de educación (no hay que escribirlo) por lo que basta validar el voto abajo.

6. Si el voto se ha realizado correctamente, el sistema nos lleva a este mensaje para indicar que se ha votado con éxito. Como veis, podéis votar a muchos otros blogs, en total a 5 por categoría (aunque no se puede votar a un mismo blog en distintas categorías).

¡Gracias! Muchísimas gracias a todos vosotros por llegar hasta aquí y realizar el proceso de votación. Por supuesto, os iremos informando, principalmente a través de las redes sociales, de cómo evoluciona el concurso.
Un canal de química interesante y divertido: Periodic Videos
Hoy os vamos a hablar de un canal de vídeos de química (en inglés) verdaderamente interesante, el canal Periodic Videos, de la Universidad de Nottingham. Es posible que ya lo conozcáis por su gran impacto: un total superior a los 500 vídeos, cinco años en activo, más de 335.000 suscriptores en Youtube y más de 17.000 seguidores en Facebook. Además, los vídeos subidos en el último mes ya superan cada uno de ellos las 50.000 visitas.
¿En qué se basa este canal? Esencialmente, en la diversión y la espectacularidad de la química, que de vez en cuando es útil (especialmente para imbuir algo de motivación en clase a los alumnos o para acercar la química a un público que está alejado de ella) pero también en explicaciones completas y con un enfoque plenamente químico a una gran cantidad de fenómenos o noticias relacionadas con la química. Además, la producción es muy buena, y si añadimos a ello al icónico profesor Brady Haran, protagonista de las explicaciones, tenemos un canal tal vez un tanto tópico pero muy interesante.
La dirección del canal es la siguiente: http://www.youtube.com/user/periodicvideos

Y la dirección de la página web, en la que los vídeos se ordenan en una tabla periódica: http://www.periodicvideos.com/
A modo ilustrativo, aquí tenéis algunos de sus más de 500 vídeos. Los títulos invitan a ver el vídeo:
1. En este se responde a la pregunta: ¿Qué pasaría si el hielo no flotase en el agua?
2. Armas químicas: el gas sarín
3. Ebullición del agua en el Everest
4. Fumata blanca y un nuevo Papa
5. Oxígeno líquido (slow motion)
Os sugiero que os fijéis en un detalle muy gracioso: el profesor ha adaptado los laterales de plástico transparente de unas gafas de seguridad de laboratorio a sus gafas de vista. ¡Increíble!

Sin duda alguna, un canal fenomenal para químicos y no químicos, y una gran iniciativa de la Universidad de Nottingham.
23 de octubre: Día del Mol, ¡felicidades químicos!
Bueno, ya sabemos que hay días para todo. Algunos de suma importancia, como el Día del agua o el Día del niño, y otros más cuestionables pero que ahí están, como el Día del espagueti (ojo, no tengo nada en contra de los espaguetis, a mí me encantan), el Día de Winnie de Pooh o el Día de la mantequilla de cacahuete. Así que, con todos estos ejemplos, ¿por qué no iba a tener el Mol, ese concepto tan importante en química (y por extensión en todo) su propio día de celebración?
Pues sí, lo tiene, y es hoy, aunque esencialmente se trata de una fiesta no-oficial que se celebra únicamente en Estados Unidos. ¿Por qué se celebra hoy? Bueno, un mol de cualquier sustancia contiene 6,02·10^23 entidades (moléculas, iones… según sea la naturaleza de dicha sustancia); dicho número recibe el nombre de Número de Avogadro, y cualquiera de vosotros que se haya enfrentado alguna vez a un cálculo estequiométrico sabrá bien su gran importancia. De modo que se escogió el día de hoy, 23 de octubre, en base al formato de fechas habitualmente usado en Norteamérica, es decir, 10/23. El Día del Mol dispone, incluso, de su propia página web donde se explican la procedencia y algunas actividades llevadas a cabo relacionadas con el mismo. En concreto se trata de una fundación y hay que pagar 25 dólares por hacerse miembro.
Tiene su punto divertido, ya que como toda “sociedad secreta” tiene su propio juramento, la promesa al mol:
Prometo lealtad al mol, a la Unión Internacional de Química Pura y Aplicada, y a la masa atómica a la que representa, un número, el más divisible, con átomos y moléculas para todos.
Como muchas otras iniciativas divertidas, su principal objetivo es despertar el interés por la química en la población con actividades interesantes y lúdicas, de modo que bienvenido sea el Día del Mol y cualquier otra actividad que nos ayude a aumentar el interés en esta ciencia tan bonita.
Así que: ¡feliz día del mol a todos los químicos y a todo el mundo en general!
También te puede interesar:
Ciencia ingrata: Amadeo Avogadro
Un canal de química interesante y divertido: Periodic Videos
Un columpio de tamaño molecular: el tetrafluoruro de azufre
En el estudio de la química se da mucha importancia a la geometría de una molécula. No se trata de un capricho de los químicos, sino de una necesidad, ya que de la geometría molecular pueden depender propiedades tan importantes como los puntos de fusión y de ebullición, la solubilidad en distintos disolventes o incluso su reactividad o su toxicidad. Cuando tenemos moléculas con pocos átomos, para la predicción de la geometría se utiliza frecuentemente un método sencillo aunque de nombre un tanto ampuloso: Repulsión de los Pares Electrónicos de la Capa de Valencia (RPECV), que como veréis en el enlace previo, hemos explicado detalladamente en uno de los vídeos de teoría del tema de enlace químico.
Dicho método se basa en el número de pares de electrones que rodean al átomo central de la molécula, de forma que en función de dicho número, los pares electrónicos de distribuirán en torno a él de una u otra forma, como se aprecia en la tabla siguiente:
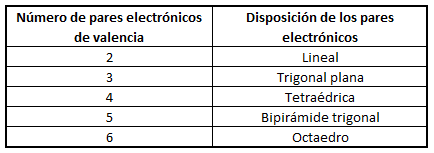
No siempre la geometría final de la molécula coincidirá con lo indicado en la tabla, ya que la presencia de pares de electrones libres (no enlazantes) modificará la disposición final de los enlaces, como ocurre en moléculas como el agua o el amoníaco.
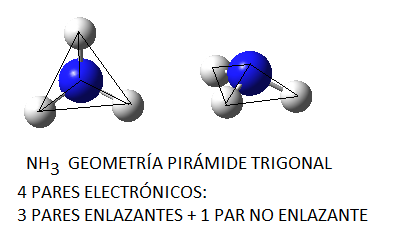
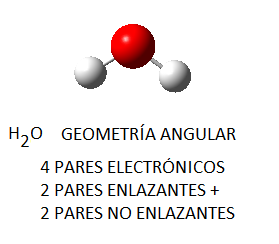
El amoníaco, NH3, en el cual el nitrógeno tiene 4 pares de electrones de valencia, uno no enlazante y tres enlazantes, tendrá geometría de pirámide trigonal, a pesar de que los pares electrónicos se dispondrán de forma tetraédrica por ser 4; del mismo modo, en el caso del agua, el oxígeno tendrá en torno a sí 4 pares electrónicos, 2 enlazantes y 2 no enlazantes, que se dispondrán tetraédricamente, pero la geometría final de la molécula de agua será angular.
El hecho de que la geometría final de la molécula dependa del total de pares electrónicos en torno al átomo central hace que en algunas ocasiones se den geometrías que pueden parecer un tanto “extravagantes”. Este es el caso de la molécula de tetrafluoruro de azufre, SF4, que presenta una geometría que recibe el nombre común de “silla de montar” o de “balancín”.
La estructura de Lewis para esta molécula es:
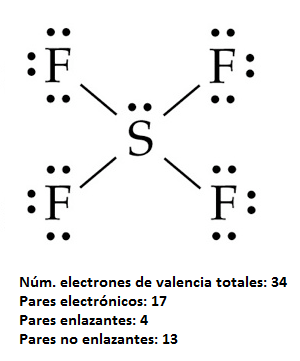
El átomo de azufre puede rodearse de más de 8 electrones en torno a él (en este caso 10) porque al tratarse de un átomo del tercer período tiene orbitales d energéticamente accesibles para ocupar.
Por tanto, el azufre central se rodea de 5 pares electrónicos, 4 enlazantes para los enlaces S-F y un par libre que va a distorsionar la estructura final. Cuando tenemos 5 pares electrónicos en torno al átomo central, la distribución de los mismos es la de una bipirámide trigonal. Si se tratase de cinco pares enlazantes, como en el caso, por ejemplo, del PCl5, tendríamos la siguiente geometría:
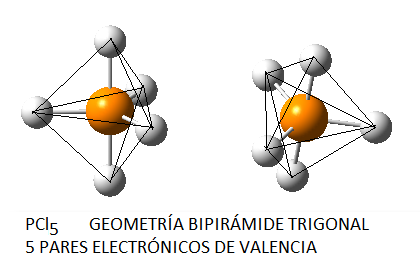
Sin embargo, en el caso del SF4, uno de estos enlaces estará sustituido por un par libre, por lo que la geometría final de dicha molécula queda como vemos a continuación con distintas perspectivas:
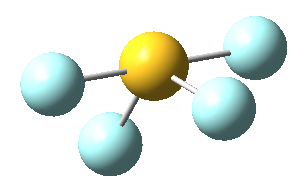
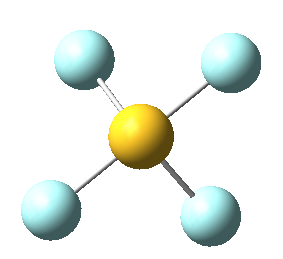
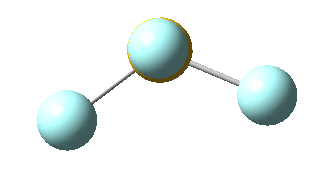
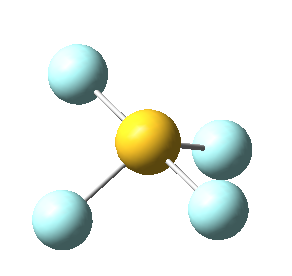
No obstante, cabe destacar que el ángulo F-S-F que aquí se observa de 180º es ligeramente menor (173,1º), ya que la repulsión electrónica entre el par libre del azufre y los pares de los enlaces azufre-flúor es mayor que la repulsión entre dos pares enlazantes, lo que hace que el ángulo se cierre ligeramente (recordemos que esto es también la causa de que los ángulos del amoníaco y del agua sean distintos de los 109,5º propios de un tetraedro perfecto).
En concreto, a continuación vemos los ángulos y distancias exactas de los enlaces del tetrafluoruro de azufre:
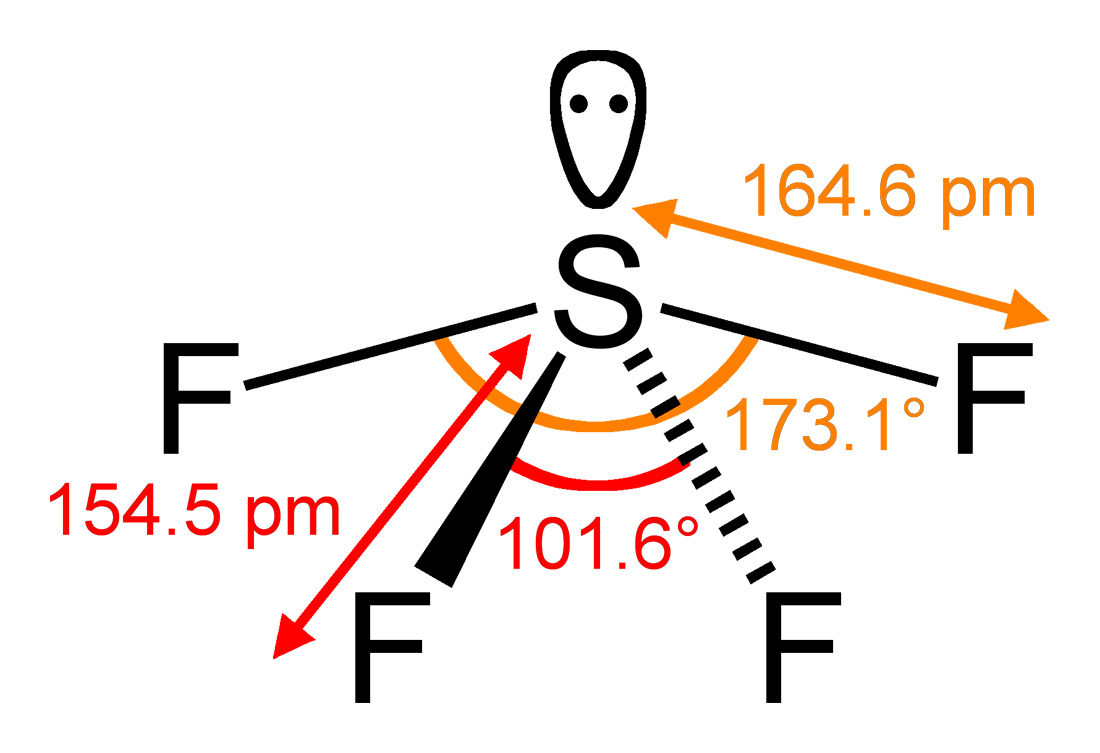
Esta geometría condiciona el hecho de que la molécula no sea apolar, como por el contrario ocurriría con una molécula similar, el hexafluoruro de azufre, SF6. En el SF4 los momentos dipolares de los 4 enlaces S-F no se anularán plenamente entre sí, sino que se sumará una de sus componentes. Esto hace, por ejemplo, que el punto de ebullición del SF4 (-38ºC) sea superior al punto de ebullición del SF6 (-64ºC), porque también serán mayores sus fuerzas intermoleculares y se requerirá mayor energía (mayor temperatura) para separar unas moléculas de otras y vaporizar el compuesto.
También te puede interesar:
Parámetros moleculares: energía de enlace, longitud de enlace y ángulo de enlace
Polaridad de enlace y polaridad molecular
Ejercicios de determinación de las estructuras de Lewis de diversas moléculas
Ejercicio de determinación de la geometría de diversas moléculas por RPECV
Política de Cookies
1. ¿Qué son las cookies? ¿Por qué utilizamos cookies en Quimitube.com?
Una cookie es un fichero que se descarga en el dispositivo del usuario al acceder a determinadas páginas web para almacenar y recuperar información sobre la navegación que se efectúa desde dicho equipo.
Las cookies permiten a dicha web, entre otras cosas, almacenar y recuperar información sobre las decisiones y hábitos del usuario. En Quimitube.com las utilizamos para personalizar la experiencia dentro de nuestra web y facilitar la navegación.
Es importante destacar que el uso de cookies no proporciona datos personales del usuario, que de cara a Quimitube.com permanece totalmente anónimo.
El usuario puede configurar su navegador para no aceptar el uso de cookies, en cuyo caso la personalización de la experiencia no se aplicaría, aunque podrá seguir accediendo a los contenidos de nuestra web con normalidad y aprendiendo del mismo modo sin restricciones (ver apartado 3. Cómo deshabilitar las cookies en el navegador).
En la página de Wikipedia (http://es.wikipedia.org/wiki/Cookie_(informática)) es posible obtener más información acerca de qué son las cookies y de qué forma funcionan. Asimismo, se puede obtener más información de este y de otros aspectos en nuestra Política de privacidad.
2. ¿Qué tipo de cookies utiliza Quimitube.com?
Las Cookies, en función de su permanencia, pueden dividirse en cookies de sesión o permanentes. Las primeras expiran cuando el usuario cierra el navegador. Las segundas expiran en función cuando se cumpla el objetivo para el que sirven o bien cuando se borran manualmente.
Adicionalmente, en función de su objetivo, las cookies pueden clasificarse de la siguiente forma:
Cookies de rendimiento: este tipo de cookie recuerda sus preferencias para las herramientas que se encuentran en los servicios, por lo que no tiene que volver a configurar el servicio cada vez que usted visita. A modo de ejemplo, en esta tipología se incluyen:
- Ajustes de volumen de reproductores de vídeo o sonido.
- Las velocidades de transmisión de vídeo que sean compatibles con su navegador.
Cookies de geolocalización: estas cookies son utilizadas para averiguar en qué país se encuentra cuando se solicita el acceso a Quimitube.com. Esta cookie es totalmente anónima, y sólo se utiliza para ayudar a orientar el contenido a su ubicación.
Cookies de registro: Quimitube.com no cuenta por el momento con una plataforma de registro de usuarios, por lo que no utiliza cookies de registro propias. Sin embargo, algunos servicios de los que sí dispone esta página web pueden utilizar conectores de terceros, tales como Facebook, Twitter o Google+. Cuando el usuario se registra en un servicio con credenciales de una red social o sistema de identificación de terceros, autoriza al mismo a guardar una cookie persistente que recuerda su identidad y le garantiza acceso a la web hasta que expira. El usuario puede borrar esta cookie y revocar el acceso a la web mediante redes sociales o sistema de identificación de terceros actualizando sus preferencias en la red social que especifica.
Cookies de analítica: Cada vez que un usuario visita Quimitube.com, una herramienta de un proveedor externo (en este caso, Google Analytics) genera una cookie analítica en el dispositivo del usuario. Esta cookie que sólo se genera en la primera visita, servirá en próximas visitas a los servicios de Quimitube.com para identificar de forma totalmente anónima al visitante. Los objetivos principales que se persiguen son:
- Permitir la identificación anónima de los usuarios navegantes a través de la “cookie” (identifica navegadores y tipos de dispositivos, nunca personas) y por tanto la contabilización aproximada del número de visitantes y su tendencia en el tiempo.
- Identificar de forma anónima los contenidos más visitados y por lo tanto más atractivos para los usuarios del sitio. Esto nos permite determinar qué temas son más útiles para dichos usuarios y agregar más contenidos en base a su interés.
- Saber si el usuario que está accediendo es nuevo o recurrente (repite visita o accede por primera vez).
La cookies analíticas de Quimitube.com nunca irán asociadas a ningún dato de carácter personal que pueda identificarle. Como se ha especificado previamente, dichas cookies sólo serán utilizadas con propósitos estadísticos, que ayuden a la optimización de la experiencia de los usuarios en el sitio.
Puede obtener más información sobre la política de privacidad de dicha herramienta analítica en Google Analytics.
Cookies de publicidad: este tipo de cookies permiten ampliar la información de los anuncios mostrados a cada usuario anónimo en Quimitube.com. Entre otros, se almacena la duración o frecuencia de visualización de posiciones publicitarias, la interacción con las mismas, o los patrones de navegación y comportamientos del usuario. Esto ayuda a conformar un perfil de su interés publicitario para ofrecer publicidad afín a sus intereses.
Para la gestión de la publicidad de Quimitube.com se utilizan herramientas de servicio de publicidad terceros. Estos terceros pueden almacenar cookies procedentes de los navegadores de los usuarios, así como acceder a los datos que en ellas se guardan (nuevamente, datos anónimos no identificativos del usuario). Las empresas que generan estas Cookies tienen sus propias políticas de privacidad.
En la actualidad, Quimitube.com utiliza como plataformas publicitarias Google Adsense y Hotwords SL. Se puede obtener más información sobre este tema en nuestra Política de Privacidad.
3. Cómo deshabilitar las cookies en el navegador
La mayoría de navegadores actualmente permiten al usuario configurar si desean aceptar cookies o no las aceptan y cuáles de ellas, por lo que en todo momento un usuario puede eliminar estas cookies de su navegador o evitar que se instalen de partida (lo cual no impide la normal navegación por Quimitube.com). Estos ajustes normalmente se encuentran en las ‘opciones’ o ‘Preferencias’ del menú de su navegador.
A continuación te indicamos los links de los principales navegadores y dispositivos para que dispongas de toda la información para consultar cómo gestionar las cookies en tu navegador.
Google Chrome™ https://support.google.com/chrome/answer/95647?hl=es&hlrm=en
Safari™: http://support.apple.com/kb/PH5042?viewlocale=es_ES http://support.apple.com/kb/HT1677?viewlocale=es_ES
Opera™ : http://help.opera.com/Windows/11.50/es-ES/cookies.html
Android http://support.google.com/android/?hl=es
Internet Explorer™ :
Versión 5
http://support.microsoft.com/kb/196955/es
Versión 6
http://support.microsoft.com/kb/283185/es
Versión 7 y 8
http://windows.microsoft.com/es-ES/windows-vista/Block-or-allow-cookies
Versión 9
http://windows.microsoft.com/es-ES/windows7/How-to-manage-cookies-in-Internet-Explorer-9
Windows Phone: http://www.windowsphone.com/es-ES/how-to/wp7/web/changing-privacy-and-other-browser-settings
Para obtener información adicional sobre cómo configurar las Cookies detallada por proveedor o administrar las distintas preferencias, se recomienda visitar el portal Your Online Choices.