En este ejercicio de enlace químico vamos a resolver una cuestión más teórica sobre los distintos enlaces carbono-carbono, es decir, el enlace simple, con hibridación sp3, y los enlaces múltiples, con hibridación sp (un carbono con triple enlace o con dos dobles enlaces) o hibridación sp2 (un carbono con un doble enlace).
El enunciado completo es:
“Los enlaces dobles y triples carbono-carbono son rígidos, sin capacidad de giro, mientras que los enlaces simples carbono-carbono pueden rotar sobre sí mismos con cierta libertad (la rotación requiere un aporte energético pequeño). Justificar este hecho en base al solapamiento orbital”.
Como veremos en el vídeo con mayor detenimiento, la justificación es la siguiente:
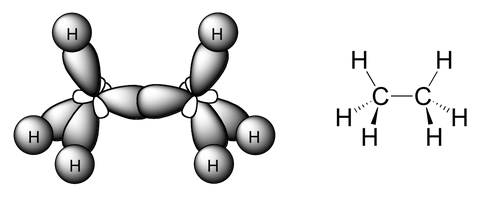
- El enlace simple C-C es un enlace de solapamiento frontal de tipo σ, entre un orbital híbrido sp3 y otro orbital híbrido sp3. El hecho de que el solapamiento sea frontal hace que pueda rotar fácilmente:
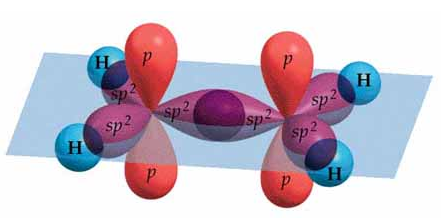
- Los enlaces dobles y triples presentan respectivamente, además del enlace simple de tipo σ, uno y dos enlaces de tipo π. Estos enlaces π corresponden al solapamiento lateral de dos orbitales p no hibridados y paralelos. Este enlace requiere que los dos orbitales estén así, estrictamente paralelos entre sí, por lo que la rotación del enlace implica necesariamente su ruptura.