La variación de energía libre de Gibbs estándar de una reacción química, ΔGo, es, como vimos en el tema de termoquímica, una variable de estado, que podemos expresar como:
ΔGo = Go productos - Go reactivos
Donde ΔGo representa la variación de energía libre en estado estándar, a 1 atmósfera de presión, 25ºC de temperatura y concentraciones de reactivos 1M.
Sin embargo, las condiciones estándar de una reacción química duran únicamente un instante. A medida que la reacción evoluciona, varía la concentración de los reactivos y el sistema ya no tiene una energía libre ΔGo sino ΔG. Ambas magnitudes se relacionan según la expresión:
ΔG = ΔGo + RT·lnQ
Donde:
ΔG: energía libre en unas condiciones dadas no estándar
ΔGo: energía libre de Gibbs estándar
R: constante de los gases ideales
T: temperatura
Q: cociente de reacción en función de las presiones parciales
Cuando el sistema alcanza el equilibrio, sabemos que ΔG = 0 y que Q = Kp, constante de equilibrio en función de las presiones parciales a una temperatura T dada. Así, tendremos:
0 = ΔGo + RT·lnKp
ΔGo = -RT·lnKp
Así, finalmente la relación entre Kp y la ΔGo es:
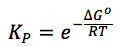
Por tanto, conociendo el valor de ΔGo de una reacción química, podemos determinar el valor de Kp a una temperatura dada, como veremos en los ejercicios resueltos.