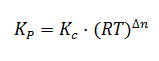Cuando se trabajo con equilibrios en los que todas las especies que intervienen son gases, es habitual utilizar la denominada constante de equilibrio Kp, en función de las presiones parciales, en lugar de Kc, en función de las concentraciones. Así, para la siguiente reacción genérica:
aA + bB ⇔ cC + dD
La constante de equilibrio Kp tiene la siguiente expresión:
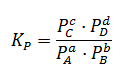
Donde Px es la presión parcial de cada uno de los componentes una vez alcanzado el equilibrio. Dichas presiones vienen expresadas en atmósferas. Como Kc, la constante de equilibrio Kp depende únicamente de la temperatura y es adimensional, no indicamos unidades.
Supongamos que para el siguiente equilibrio tenemos los siguientes datos de presiones parciales en el equilibrio:
N2(g) + O2(g) ⇔ 2NO(g)
PN2 = 178,8 atm; PO2 = 88,5 atm; PNO = 3,6atm
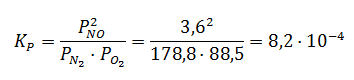
Aunque es frecuente expresar la constante de equilibrio entre gases como Kp, también se puede expresar como Kc y, de hecho, existe una relación entre ambas constantes, de forma que conociendo Kp se puede calcular Kc y viceversa. Vamos a deducirla.
Para relacionar ambas constantes, partiremos de la ecuación de los gases ideales:
P·V = n·R·T
Donde:
P: presión en atmósferas
V: volumen en litros
n: número de moles
R: constante de los gases ideales, 0,082 atm·L/K·mol
T: temperatura, en K
Despejando la presión:
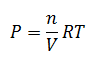
Sustituyendo la presión en la expresión de Kp para cada componente:
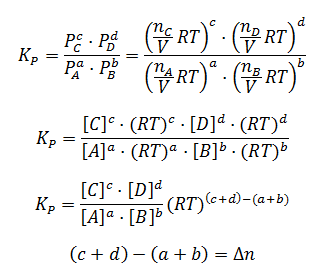
Finalmente, llegamos a la siguiente expresión