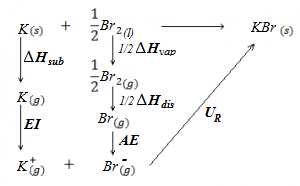
En el siguiente ejercicio calcularemos la energía reticular del bromuro potásico, KBr, a partir del ciclo de Born-Haber, utilizando para ello los datos siguientes:
ΔHf (KBr) = -391,8 kJ/mol
(entalpía de formación del bromuro potásico, energía desprendida cuando se forma un mol de bromuro potásico a partir de sus elementos en estado natural, es decir, potasio sólido metálico y bromo diatómico líquido)
ΔHvap (Br2) = 30,7 kJ/mol
(entalpía de vaporización del bromo, es decir, energía necesaria para pasar de líquido a vapor).
ΔHdis (Br2) = 193,5 kJ/mol
(entalpía de disociación del bromo, es decir, energía necesaria para pasar de molécula diatómica gaseosa a átomos individuales gaseosos, Br2(g) –> 2Br(g)).
ΔHsub (K) = 81,3 kJ/mol
(entalpía de sublimación del potasio, energía necesaria para pasar de potasio sólido a potasio gaseoso).
EI (K) = 418,4 kJ/mol
(energía de ionización del potasio, energía necesaria para ionizar el potasio, abstrayendo el electrón de valencia y pasando a catión potasio, K+).
AE Br = -321,9 kJ/mol
(afinidad electrónica del bromo, energía desprendida cuando un átomo de bromo en estado gaseoso capta un electrón para pasar a anión bromuro, Br-).
También te pueden interesar los ejercicios siguientes: