En este ejercicio determinaremos la energía reticular del fluoruro cálcico, CaF2, tanto a partir del ciclo de Born-Haber como de la ecuación de Born-Landé, comparando ambos valores.
El enunciado completo es:
A partir de los datos expuestos, calcular la energía reticular del fluoruro cálcico a partir del ciclo de Born-Haber y de la ecuación de Born-Landé.
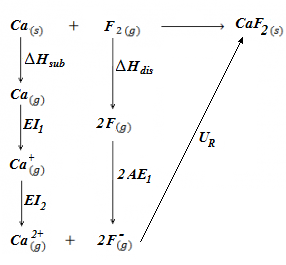
ΔHsub (Ca) = 193 kJ/mol
(entalpía de sublimación del calcio, es decir, energía necesaria para pasar el calcio de sólido a vapor).
EI1 (Ca) = 540 kJ/mol
(primera energía de ionización del calcio, es decir, energía necesaria para abstraer un electrón de valencia del calcio gaseoso, quedando el catión Ca+ también en estado gaseoso).
EI2 (Ca) = 1150 kJ/mol
(segunda energía de ionización del calcio, es decir, energía necesaria para abstraer el segundo electrón de valencia del catión Ca+, quedando como catión Ca2+, en estado gaseoso).
ΔHdis (F2) = 158 kJ/mol
(entalpía de disociación del flúor, energía necesaria para disociar la molécula diatómica F2 a átomos individuales, F(g)).
AE (F) = -333 kJ/mol
(afinidad electrónica del flúor, energía desprendida cuando un átomo de flúor capta un electrón para quedar como anión fluoruro, F-).
ΔHf (CaF2) = -1214,6 kJ/mol
(entalpía de formación del fluoruro de calcio, energía desprendida cuando se forma un mol del compuesto sólido a partir de sus elementos en estado natural, es decir, calcio metálico sólido y flúor diatómico y gaseoso).
Distancia interiónica = 2,35 Å
Cte de Madelung = 2,5194
Coef. Born o factor de compresibilidad = 8
K (constante de Coulomb) = 9·10^9 N·m2/C2
e = 1,60·10^(-19) C
El ciclo de Born-Haber para este compuesto se representa del siguiente modo:
Tal vez también te interese:
Ciclo de Born-Haber para el fluoruro sódico, NaF
Ordenar de mayor a menor energía reticular KI, CaS, KF y CaO
Energía reticular y punto de fusión de NaF, KF, LiF y NaF, NaCl, NaBr
Comparación de la dureza de dos compuestos iónicos por la ecuación Born-Landé