En este ejercicio vamos a determinar la energía reticular del óxido de magnesio, MgO. La diferencia con respecto a los ejercicios del Ciclo de Born-Haber realizados previamente se halla en el hecho de que el anión oxígeno presenta una carga neta de -2, por lo que debemos considerar dos valores de afinidad electrónica, un primer valor para pasar de O(g) a O(-)(g), y un segundo valor para pasar de O(-)(g) a O(-2)(g). Del mismo modo, para el magnesio debemos considerar dos valores de energía de ionización, un primer valor para pasar de Mg(g) a Mg(+)(g), y un segundo valor para pasar de Mg(+)(g) a Mg(2+)(g), tal y como se puede apreciar en el esquema del ciclo de Born-Haber.
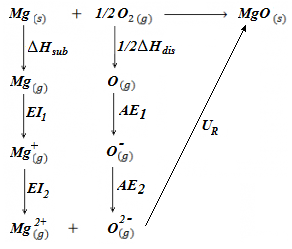
Los datos de que disponemos para realizar el cálculo de la energía reticular del óxido de magnesio son:
ΔHf (MgO) = -602,0 kJ/mol
(entalpía de formación del óxido de magnesio, energía desprendida cuando se forma un mol del compuesto sólido a partir de sus elementos en estado natural, es decir, magnesio metálico, sólido, y oxígeno como gas diatómico).
ΔHsub (Mg) = 146,1 kJ/mol
(entalpía de sublimación del magnesio, es decir, energía necesaria para que el magnesio metálico en estado sólido pase a magnesio vapor).
ΔHdis (O2) = 498,2 kJ/mol
(entalpía de disociación del oxígeno, energía necesaria para pasar de oxígeno diatómico gaseoso a átomos individuales de oxígeno en estado gaseoso).
EI1 (Mg) = 736,3 kJ/mol
(primera energía de ionización del magnesio, energía necesaria para abstraer un primer electrón de valencia y pasar de Mg(g) a Mg(+)(g)).
EI2 Mg = 1447,9 kJ/mol
(segunda energía de ionización del magnesio, energía necesaria para abstraer el segundo electrón de valencia y pasar de Mg(+)(g) a Mg(2+)(g)).
AE1 (O) = -141,2 kJ/mol
(primera afinidad electrónica del oxígeno, energía necesaria para pasar de O(g) a O(-)(g)).
AE2 (O) = -791,0 kJ/mol
(segunda afinidad electrónica del oxígeno, energía necesaria para pasar de O(-)(g) a O(2-)(g)).