Este es el primer ejercicio en el que vamos a utilizar la Ley de Hess para calcular el valor de una entalpía de reacción, en concreto de la reacción de formación de etanol a partir de sus elementos en estado fundamental, es decir, carbono grafito, hidrógeno gaseoso y oxígeno gaseoso. En primer lugar debemos plantear dicha reacción de formación y, una vez planteada, veremos cómo podemos combinar las reacciones químicas aportadas en el enunciado (la reacción de combustión de etanol, la reacción de formación de dióxido de carbono y la de formación de agua) para lograr que por combinación de estas se obtenga la reacción objetivo. Una vez que hayamos determinado los coeficientes por los que es necesario multiplicar cada ecuación termoquímica para llegar a la ecuación problema, aplicaremos estos mismos coeficientes a los valores de entalpía para calcular la entalpía de formación del etanol.
El enunciado completo es el siguiente:
Usar la Ley de Hess para calcular la entalpía estándar de formación del etanol con los datos aportados:
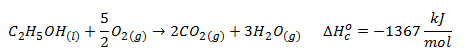


También te puede interesar:
Termoquímica Teoría 14: Ley de Hess para el cálculo de la entalpía de reacción. Aditividad de las entalpías.