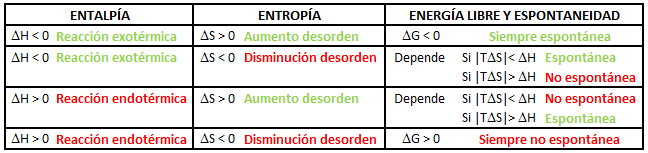
Hemos visto en apartados previos que en una reacción química hay dos fuerzas impulsoras diferenciadas. Por una parte, se ve favorecido el sentido de la reacción en el que hay una disminución de entalpía de reactivos a productos, es decir, el sentido exotérmico, mientras que, por otra parte, se favorece el sentido de la reacción en el que hay un aumento de entropía, ΔS > 0, es decir, un aumento del desorden. De ambos factores, ΔH y ΔS, dependerá que una reacción química sea espontánea o no espontánea. Ambos factores pueden ir en el mismo sentido o estar contrapuestos, teniendo tres posibles situaciones distintas:
1) Puede ser que tanto ΔH como ΔS sean favorables, con lo cual la reacción será en todo caso espontánea, independientemente de la temperatura.
2) Puede ser, por el contrario, que tanto ΔH como ΔS sean desfavorables, con lo cual la reacción será no espontánea a cualquier temperatura.
3) Puede ser que una de las dos variables sea favorable y la otra desfavorable, con lo cual el resultado final dependerá de la magnitud de ambos, es decir, de cuál de estas dos fuerzas impulsoras contrapuestas tenga mayor peso en el resultado final, así como de la temperatura.
Estas tres posibles situaciones hacen pensar que debe haber una relación matemática entre la entalpía y la entropía, dependiente de la temperatura, que las combine ambas y nos sirva para predecir la espontaneidad o no espontaneidad de una reacción química. Aunque no vamos a deducir dicha relación, es una nueva magnitud, llamada Energía Libre de Gibbs, que viene dada por la expresión siguiente:
G = H – TS
G es una función de estado extensiva (depende únicamente del estado inicial y final y de la cantidad total de materia que contenga el sistema considerado). Si estamos considerando una reacción química, en la que pasamos de unos reactivos a unos productos, la expresaremos como incrementos:
ΔG = ΔH – TΔS
El factor de entalpía, ΔH, representa la energía total del sistema, mientras que el factor TΔS representa la energía no aprovechable de dicha energía total, es decir, energía que el sistema no puede utilizar para realizar un trabajo. Por esto a ΔG se la llama energía libre o entalpía libre, porque es la fracción o la cantidad de la energía total que sí puede ser aprovechable como trabajo útil. Por este motivo es dicha magnitud, y no la entalpía ni la entropía, el factor determinante de la espontaneidad de una reacción química, ya que representa la energía efectivamente disponible en procesos realizados a presión y temperatura constante. Así, en función del signo de la variación de energía libre de Gibbs, tenemos tres posibilidades:
ΔG > 0, positivo: Reacción no espontánea
ΔG = 0, Sistema en equilibrio
ΔG < 0, negativo: Reacción espontánea
Teniendo en cuenta la expresión matemática considerada, podemos establecer el signo de la variación de energía libre de Gibbs de forma cualitativa conociendo los signos de la variación de entalpía y de la variación de entropía, ΔH y ΔS. Así, tendremos cuatro posibilidades distintas: