En este ejercicio resuelto de termodinámica química vamos a calcular la entalpía de la reacción de oxidación a ácido acético por parte del oxígeno, utilizando la Ley de Hess. El enunciado completo es el siguiente:
Calcular la entalpía de la reacción de oxidación de etanol a ácido acético, sabiendo que en la combustión de 10 gramos de etanol se desprenden 300 kJ y en la combustión de 10 gramos de ácido acético se desprenden 140 kJ.
Como se puede observar, en el enunciado no nos dan las ecuaciones termoquímicas que tenemos como dato, tal como ocurría en el ejercicio previo, sino que tenemos que plantearlas a partir de lo indicado en el enunciado. Asimismo, los datos de entalpía aportados vienen dados como kJ desprendidos (signo negativo para la entalpía) por cada 10 gramos de compuesto que reacciona; será necesario, por tanto, plantear y ajustar correctamente las reacciones y realizar algunos cálculos estequiométricos para poder disponer de los valores de entalpía de reacción en kJ/mol. Una vez hecho esto, las reacciones de combustión de etanol y ácido acético obtenidas serán las siguientes:
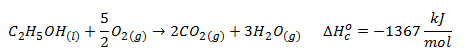

También te puede interesar:
Termoquímica Ejercicio 26: Ley de Hess para el cálculo de la entalpía de formación del etanol