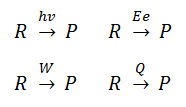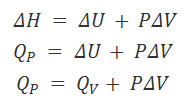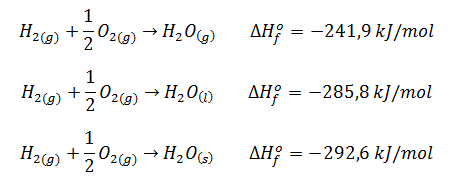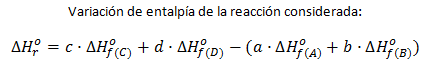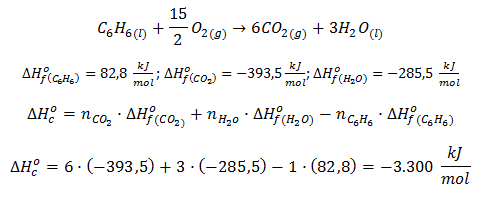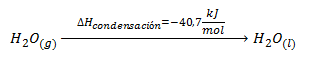Concepto de entalpía de reacción estándar: condiciones termoquímicas estándar
Vamos a profundizar en este apartado en un concepto fundamental en termoquímica, el concepto de entalpía de reacción, ΔHr. Definimos la entalpía de una reacción química como el calor absorbido o desprendido en dicha reacción química cuando ésta transcurre a presión constante, es decir:
ΔH = QP
ΔH : entalpía de la reacción
QP : calor transferido a presión constante
El valor de entalpía es distinto según a qué presión y a qué temperatura se lleve a cabo la reacción. Por este motivo se definen unas condiciones estándar. Las condiciones estándar termoquímicas son 25ºC (o 298 K) y 1atm de presión (1,013·10^5 Pa). Cuando la reacción se lleva a cabo en dichas condiciones estándar, su variación de entalpía (ΔH) recibe el nombre de entalpía estándar de reacción o también entalpía normal de reacción, y se representa como ΔHor.
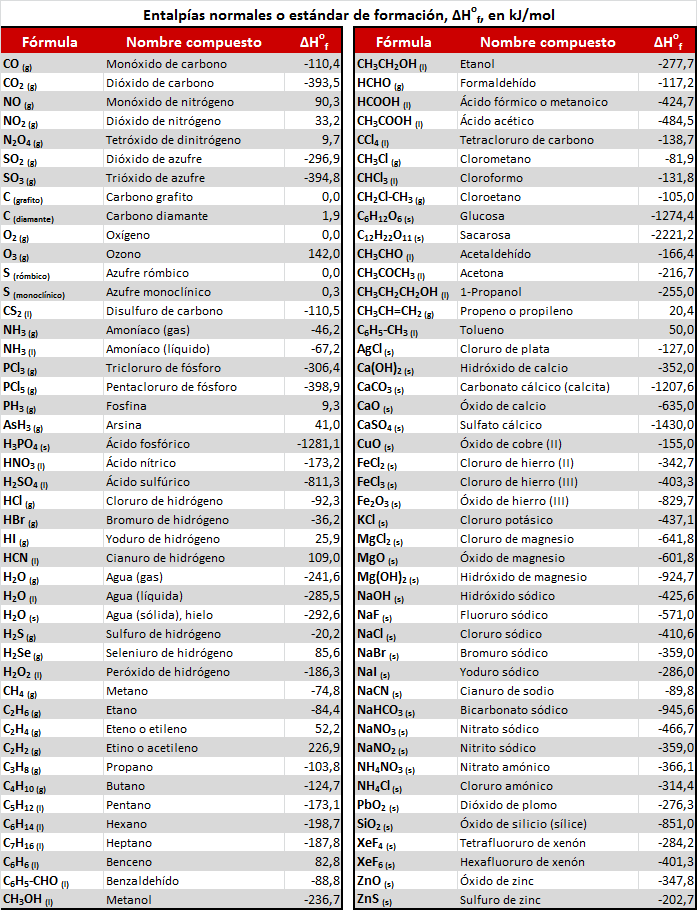
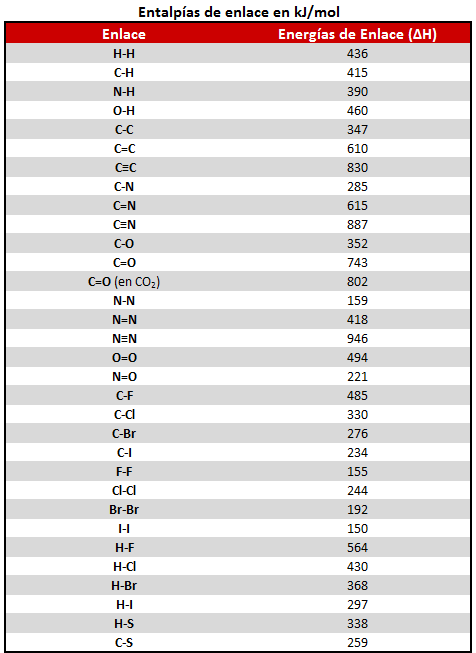
Las unidades de la entalpía estándar de reacción son kJ o kJ/mol, siendo esta última la forma más habitual de hallar los valores de entalpías en las distintas tablas.
Ecuaciones termoquímicas
La forma más habitual de indicar la entalpía estándar de una reacción química es en las llamadas ecuaciones termoquímicas, que consisten en escribir la reacción, correctamente ajustada y con los estados de agregación de todos los compuestos que intervienen, y añadir, a la derecha, el valor de la entalpía estándar. Por ejemplo, a continuación vemos la ecuación termoquímica para la reacción de combustión del etanol y para la reacción de combustión del monóxido de carbono:
El motivo de que en la ecuación termoquímica se deban indicar los estados de agregación de productos y reactivos, es decir, si son gases, líquidos o sólidos, y también la forma alotrópica (por ejemplo, carbono grafito o carbono diamante), es porque de ello también depende el valor de la entalpía de la reacción.
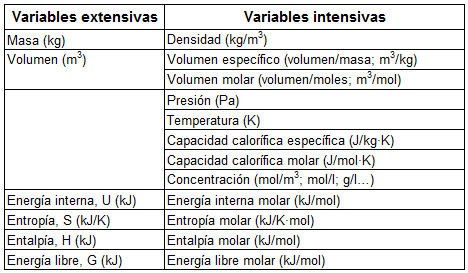
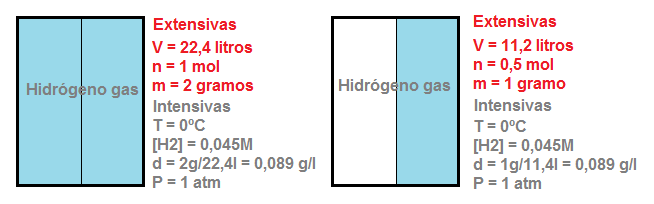
Además, puesto que la entalpía es una variable extensiva, es decir, depende de la cantidad total de materia, si la ecuación termoquímica se ajusta de un modo distinto, cambiará su valor, siempre y cuando el valor venga dado en kJ (y no en kJ/mol). Por ejemplo:
![Ecuación termoquímica de la reacción de formación de CO2 a partir de CO ajustada para 2 moles Ecuación termoquímica de la reacción de formación de CO2 a partir de CO ajustada para 2 moles]()
Esta ecuación termoquímica nos indica que cuando 2 moles de monóxido de carbono reaccionan con un mol de O2, se desprenden 566 kJ de calor, mientras que, tal y como hemos visto previamente en la misma reacción pero ajustada para 1 mol, se desprenden la mitad, 283 kJ de energía calorífica.
Reacciones endotérmicas y reacciones exotérmicas
En las ecuaciones termoquímicas indicadas previamente aparecen los correspondientes valores de entalpía estándar de reacción para diversas reacciones, y todas ellas tienen signo negativo. ¿Qué significa el signo de la entalpía? Según el criterio establecido por la IUPAC, que hemos explicado al hablar de la transferencia de energía en forma de calor, es negativo el calor desprendido por el sistema, y positivo el calor absorbido por el sistema. Así, si la entalpía de reacción es negativa, significa que durante el transcurso de la reacción, el sistema pierde o libera calor hacia el entorno, mientras que si la entalpía de reacción es positiva significa que durante el transcurso de la reacción, el sistema absorbe calor del entorno. En función del signo de la entalpía, las reacciones se clasifican como endotérmicas y exotérmicas:
- Una reacción exotérmica es aquella cuyo valor de entalpía es negativo, es decir, el sistema desprende o libera calor al entorno (ΔH < 0).
- Una reacción endotérmica es aquella cuyo valor de entalpía es positivo, es decir, el sistema absorbe calor del entorno (ΔH > 0).
Por ejemplo, la reacción que hemos considerado previamente, de oxidación del monóxido de carbono para dar dióxido de carbono, tiene variación de entalpía negativa:
Esto significa que se desprende calor en el transcurso de la misma y es, por tanto, una reacción exotérmica, mientras que si consideramos la misma reacción pero en sentido contrario, el valor absoluto de la entalpía se mantiene, pero el signo cambia, siendo en este caso la entalpía positiva y, por tanto, una reacción endotérmica:
Distintos tipos de entalpías de reacción: entalpías de combustión y entalpías de formación.
Aunque cualquier entalpía es, por definición, una entalpía de reacción (variación de calor a presión constante asociada a una reacción química) es frecuente especificar un poco más y, en lugar de llamarla entalpía de reacción, indicamos el tipo de reacción a que se refiere, por ejemplo, en el caso del CO y el oxígeno, se trata de una reacción de combustión, por lo que a su entalpía de reacción se la puede llamar entalpía de combustión, ΔHoc
Del mismo modo sucede, por ejemplo, con las entalpías de las reacciones de formación de un compuesto, que reciben el nombre de entalpías de formación, y que veremos con detenimiento en el apartado próximo por su gran utilidad y la frecuencia de su uso.
Diagramas de entalpía
Un diagrama de entalpía es un gráfico que permite mostrar de un modo visual la variación de entalpía de una reacción química. Si nosotros tenemos una reacción:
R –> P ΔHoR
![Variación de entalpía en una reacción química Variación de entalpía en una reacción química]()
Como el valor absoluto de entalpía no se conoce, el origen de la escala de entalpías es arbitrario. Por ello, lo que se hace es representar reactivos y productos, siendo la diferencia entre ellos el valor de entalpía de la reacción.
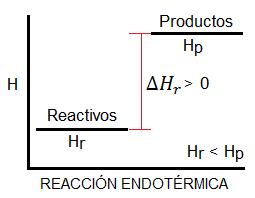
Si la reacción es endotérmica, es decir, absorbe calor, el diagrama de entalpía tendrá la forma siguiente:
![Diagrama de entalpía para una reacción endotérmica Diagrama de entalpía para una reacción endotérmica, es decir, con entalpía positiva]()
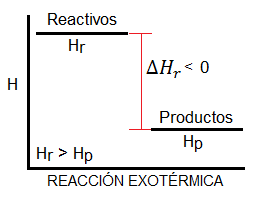
Si la reacción es exotérmica, es decir, desprende calor, el diagrama de entalpía tendrá la forma siguiente:
![Diagrama de entalpía para una reacción exotérmica Diagrama de entalpía para una reacción exotérmica, es decir, con entalpía negativa]()