Article 3
Article 2
Article 1
Article 0
Enlace Químico ejercicio 33: Determinar qué compuestos del grupo presentan enlace de hidrógeno
En este ejercicio determinaremos qué compuestos de un grupo presentarán enlace de hidrógeno. El enunciado es el siguiente:
Determinar en cuáles de los compuestos siguientes se darán enlaces de hidrógeno: HF (fluoruro de hídrogeno), H2O (agua), CH3CH2OH (etanol), CH3NH2 (metilamina), H2O2 (peróxido de hidrógeno o agua oxigenada), NH3 (amoniaco), CH3OCH3 (dimetiléter o metoximetano), PH3 (fosfina) y CH3COOH (ácido acético).
Para poder realizar este ejercicio debemos escribir las estructuras de Lewis de cada uno de los compuestos y recordar cuándo se dará un enlace de hidrógeno. Se dará cuando una molécula covalente presente un enlace entre un átomo de hidrógeno y un átomo pequeño y electronegativo como nitrógeno, flúor u oxígeno. Así, las moléculas que presentarán enlace de hidrógeno de la serie indicada serán: HF, H2O, CH3CH2OH, CH3NH2, H2O2, NH3 y CH3COOH, y no lo presentarán ni PH3 ni CH3OCH3.
Polaridad y apolaridad: una experiencia visual y divertida
A través del blog Clúster de divulgación científica y de su canal de Youtube (¡altamente recomendado!) he llegado a este vídeo que es tan adecuado para el tema en el que nos hemos estado moviendo últimamente, el de enlace químico y de polaridad y apolaridad de las moléculas covalentes.
En el vídeo vemos lo que ocurre cuando acercamos una barra de ebonita (un polímero negro de elevada dureza, que se obtiene tras vulcanizar caucho puro sucesivamente con azufre) después de haberla frotado con piel para que adquiera electricidad estática (exceso de electrones en su superficie), a un chorrito de hexano y a un chorrito de agua.
Es mejor que lo veáis por vosotros mismos:
Y… ¿qué es lo que está ocurriendo?
El hexano, compuesto orgánico formado por 6 carbonos con hibridación sp3, de fórmula CH3CH2CH2CH2CH2CH3, es un compuesto totalmente apolar. La diferencia de electronegatividad entre el hidrógeno y el carbono es pequeña y, además, los pequeños momentos dipolares que pueden darse en dichos enlaces se anulan por geometría (cada uno de los carbonos, por presentar hibridación sp3, tendrá una geometría tetraédrica). Ya hemos visto en algunos ejercicios de enlace químico la famosa regla nmemotécnica de “semejante disuelve a semejante”. Esto es similar. El hexano, apolar, y la ebonita, cargada negativamente de forma neta por frotación, no se atraen electrostáticamente. Por eso el chorrito de hexano no se desvía ni se altera, no ocurre nada.
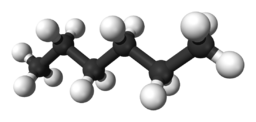
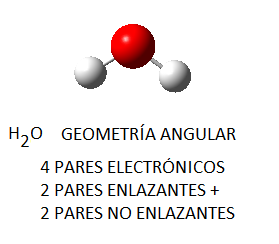
Las moléculas de agua, en cambio, presentan una elevada polaridad (son dipolos permanentes) por la diferencia de electronegatividad entre el hidrógeno y el oxígeno (lo que hará que los enlaces sean bastante polares) y por su geometría angular (los momentos dipolares de los dos enlaces H-O no pueden anularse por geometría).
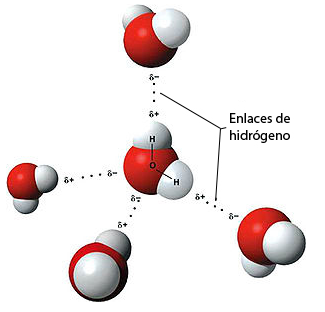
Esta polaridad del agua hace que la ebonita cargada atraiga el agua, y este es el motivo de que se desvíe el chorro de una forma tan espectacular.
Enlace Químico ejercicio 34 Determinar la polaridad, contribución iónica y enlace de hidrógeno de H2O, HF, H2, CH4 y NH3
En este ejercicio responderemos una serie de cuestiones acerca de un grupo de moléculas covalentes de distinta polaridad. El enunciado completo es:
Considerando las moléculas: H2O, HF, H2, CH4 y NH3:
a) ¿Cuáles son polares?
b) ¿Cuál presenta el enlace con más contribución iónica?
c) ¿Cuál presenta el enlace con más contribución covalente?
d) ¿Cuáles pueden formar enlace de hidrógeno?
Para determinar la polaridad o apolaridad de las moléculas covalentes debemos tener en cuenta tanto la diferencia de electronegatividad de los enlaces como la geometría, para determinar si los momentos dipolares se anulan o no se anulan por la disposición geométrica de los enlaces (por ejemplo, en el agua, que es angular, los momentos dipolares no se anularán y la molécula será polar, pero en el metano, que es tetraédrico, se anularán por dicha geometría y será globalmente apolar). También la diferencia de electronegatidad será el parámetro que utilizaremos para determinar cuál de estos compuestos es el que presenta un mayor carácter iónico o un mayor carácter covalente, tal y como hemos hecho en algunos ejercicios previos sobre contribución iónica y covalente de los enlaces. Para ello, según Pauling, el 50% de carácter iónico corresponde a una diferencia de electronegatividad de 1,7, en general:
- ΔEN = 1,7 Carácter iónico 50%
- ΔEN > 1,7 Enlace iónico, carácter iónico > 50%
- ΔEN < 1,7 Enlace covalente, carácter iónico < 50%
En cuanto a la formación de enlaces de hidrógeno debemos observar si la molécula, además de ser polar, presenta enlaces entre hidrógeno y un átomo pequeño y electronegativo como flúor, nitrógeno y oxígeno.
Tal vez también te interesen estos ejercicios:
Cálculo del porcentaje de carácter iónico con la diferencia de electronegatividades
Determinar qué compuestos del grupo presentan enlaces de hidrógeno
Enlace Químico ejercicio 35: Determinar las fuerzas intermoleculares que hay que vencer para fundir hielo, sublimar yodo y vaporizar NH3
En este ejercicio vamos a determinar qué fuerzas intermoleculares es necesario vencer o romper para producir una serie de cambios físicos, es decir, ciertos cambios de estado de las sustancias que no implican cambio químico, no hay reacción química. El enunciado completo es:
Indica qué tipo de fuerzas intermoleculares hay que vencer para:
a) fundir el hielo
b) sublimar yodo
c) vaporizara amoníaco
Para la fusión del hielo se debe romper la precisa estructura de enlaces de hidrógeno que mantiene la estructura cristalina formada, tal y como se muestra en la siguiente figura:
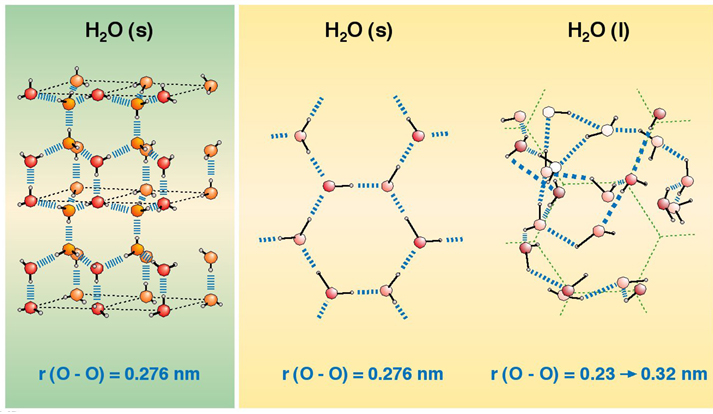
Vemos que en al agua líquida, una vez fundido el hielo, seguirán existiendo enlaces de hidrógeno que mantienen las moléculas de agua unidas en estado líquido, pero se trata de enlaces de hidrógeno con una disposición caótica y dinámica y no precisos y estructurados como en el hielo.
En cuanto al yodo, puesto que se trata de una molécula diatómica I2, formada por dos átomos idénticos, la diferencia de electronegatividad en el enlace I-I es nula y será totalmente apolar. Por ello, la única posibilidad que presenta esta molécula para formar dipolos es la formación de dipolos instantáneos, es decir, que en un momento dado, la nube electrónica se desplace más hacia un lado de la molécula provocando una distribución asimétrica de la carga (densidad de carga positiva, δ+, y negativa, δ-), ya que se trata de átomos grandes con una nube electrónica grande y polarizable. Así dará lugar a un dipolo instantáneo durante un breve instante de tiempo, que puede inducir dipolos en moléculas vecinas, dando lugar a dipolos inducidos.
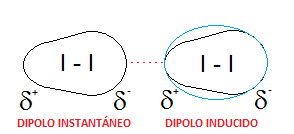
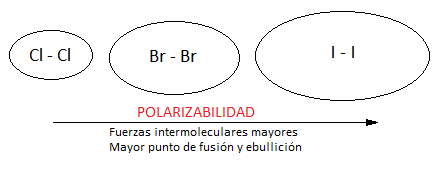
Las fuerzas que se establecerán entre moléculas de yodo serán dipolo instantáneo – dipolo inducido, que reciben el nombre de fuerzas de dispersión o fuerzas de London. Aunque se trata de fuerzas débiles, el hecho de que la molécula de I2 tenga una masa considerable hará que sea sólido a temperatura ambiente y que haya que romper estas fuerzas aumentando la temperatura para lograr sublimar el compuesto. Es decir, la intensidad de estas fuerzas intermoleculares depende de la masa del compuesto, como vemos en el siguiente esquema:
Por último, en el caso del amoníaco, dado que la geometría de la molécula es de pirámide trigonal, tal y como podemos predecir en base a la teoría de repulsión de pares electrónicos de la capa de valencia y como vemos en la siguiente figura:
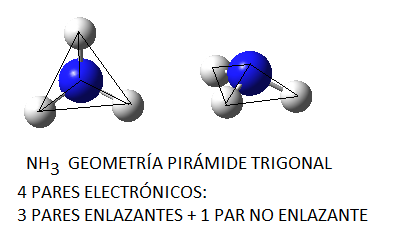
Y puesto que los enlaces N-H son polares (electronegatividad del nitrógeno de 3,0 y del hidrógeno de 2,1) esto hará que la molécula sea globalmente polar y que establezca interacciones dipolo permanente – dipolo permanente. Además, puesto que se trata de un enlace combinación de un átomo de hidrógeno y un átomo pequeño y electronegativo del grupo N,F u O, estas fuerzas estarán clasificadas como enlaces de hidrógeno. Por este motivo, son estas las fuerzas, es decir, los enlaces de hidrógeno, las que habrá que vencer para que el amoníaco líquido pase a estado gaseoso.
Enlace Químico ejercicio 36: fundir cloruro potásico, hervir agua y disolver yodo en benceno
En este ejercicio vamos a determinar el tipo de enlace químico o fuerza intermolecular que habrá que vencer para producir ciertos cambios físicos. El enunciado completo es:
Indicar qué tipo de interacción o enlace hay que romper para:
a) Fundir cloruro potásico
b) Hervir agua
c) Disolver yodo en benceno
- El cloruro potásico, KCl, es un compuesto formado por un metal alcalino, el potasio, que es por tanto muy poco electronegativo (electronegatividad del potasio 0,8) y un no metal, en concreto un halógeno, el cloro, muy electronegativo (electronegatividad del cloro 3,0). Así, formará una red cristalina cuyos componentes serán los cationes K+ y los aniones Cl-. Será esta interacción no direccional y de tipo fuerte entre iones la que debe romperse para fundir el compuesto, motivo por el cual los compuestos iónicos suelen tener puntos de fusión elevados.
- Para hervir agua hay que romper los enlaces de hidrógeno que se dan en el agua líquida. A diferencia de la fusión, el paso de hielo a líquido, en la que no se rompen la totalidad de los enlaces de hidrógeno, en el agua líquida sí deben romperse la totalidad de ellos para que las moléculas sean independientes las unas de las otras, es decir, estén en fase gas. Por esto, el punto de ebullición del agua es inusualmente elevado, porque los enlaces de hidrógeno son fuerzas de una magnitud considerable.
- Puesto que el yodo es un compuesto apolar, será soluble en disolventes apolares, como es el caso del benceno, porque ambos compuestos podrán establecer entre ellos interacciones que permiten al soluto permanecer disuelto en el seno del disolvente. Al ser el yodo apolar, las fuerzas que mantienen unidas las distintas moléculas serán fuerzas de dispersión o de London (también llamadas fuerzas dipolo instantáneo – dipolo inducido), y serán las que habrá que romper para lograr que el benceno disuelva el sólido.
Enlace Químico ejercicio 37: Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
En este ejercicio debemos indicar las propiedades físicas diferenciales que tendrán el cobre, el dióxido de carbono y el fluoruro de cesio a partir de los enlaces de cada uno de ellos.
El cobre es un sólido metálico y, como tal, está formado por una red cristalina de cationes cobre y presenta electrones deslocalizados, que pueden moverse con libertad por toda la red cristalina. Por este motivo tendrá elevada conductividad eléctrica y térmica. Además, al ser una red cristalina, es un compuesto duro y compacto, aunque es dúctil y maleable, como son en general los metales, porque la movilidad de unas capas catiónicas sobre otras no provocan la ruptura del sólido. Además, sus puntos de fusión y ebullición serán elevados, como consecuencia de la fortaleza del enlace metálico. No es soluble en agua.

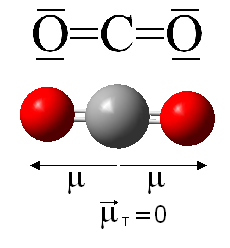
En cuanto al dióxido de carbono, se trata de una molécula covalente lineal. Aunque sus enlaces son polares (la electronegatividad del oxígeno es de 3,5 y la del carbono 2,5, por lo que la diferencia es de 1,0) será globalmente apolar por geometría. Por este motivo, el CO2 es un gas a temperatura ambiente y en general presenta puntos de fusión y de ebullición muy bajos, ya que las únicas fuerzas intermoleculares que podrán presentar entre sí distintas moléculas de CO2 serán fuerzas de dispersión o de London, por formación de dipolos instantáneos. No será conductor de la corriente eléctrica, ya que está formado por moléculas aisladas, y los electrones no tienen libertad de movimiento en un enlace covalente. Además, tampoco será soluble en agua.
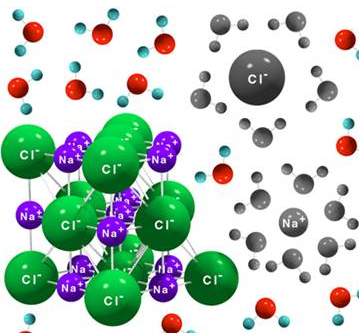
Finalmente, el fluoruro de cesio es un compuesto iónico, ya que está formado por un átomo muy electronegativo, el flúor (electronegatividad del flúor = 4,0) y un átomo muy poco electronegativo, el cesio (electronegatividad del cesio = 0,7), por lo que la unión de ambos dará lugar a una red cristalina formada por cationes Cs+ y por aniones F-, que tendrá elevada dureza, aunque será frágil. También presentará elevados puntos de fusión y de ebullición, porque habrá que vencer las fuerzas de atracción electrostática para separar los iones y fundir o evaporar el compuesto. Adeemás, será soluble en agua porque la molécula de H2O forma dipolos permanentes capaces de solvatar los iones. No conducirá la corriente eléctrica en estado sólido, pero sí lo hará en estado disuelto o fundido por la capacidad de movilidad de los iones.
A continuación vemos un ejemplo de la disolución de un compuesto iónico en el agua, el NaCl, cloruro de sodio, que es análoga a la disolución del fluoruro de cesio en agua:
Exámenes Química Selectividad Castilla y León
A continuación encontrarás unos archivos pdf con los enunciados de los exámenes de Selectividad de Química propuestos en la Comunidad de Castilla León los años 2009, 2010, 2011 y 2012, en las convocatorias de junio y de septiembre:
Examen Química Selectividad Castilla y León Junio 2009
Examen Química Selectividad Castilla y León Septiembre 2009
Examen Química Selectividad Castilla y León Junio 2010
Examen Química Selectividad Castilla y León Septiembre 2010
Examen Química Selectividad Castilla y León Junio 2011
Examen Química Selectividad Castilla y León Septiembre 2011
Examen Química Selectividad Castilla y León Junio 2012
Examen Química Selectividad Castilla y León Septiembre 2012
Modelo de Examen de Química de Selectividad Castilla y León para 2013
Article 0
Enlace Químico ejercicio 38: Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
En este ejercicio de enlace químico debemos explicar razonadamente ciertos hechos experimentales, que son:
a) El cloro, Cl2, es un gas a temperatura ambiente, mientras que el cloruro potásico, KCl, funde a 776ºC.
El cloro es una sustancia formada por moléculas covalentes diatómicas que únicamente pueden formar entre sí fuerzas de dispersión o de London (dipolo instantáneo – dipolo inducido), que son muy débiles y no logran mantener unidas a las moléculas muy fuertes entre sí, y por este motivo es un gas a temperatura ambiente. El KCl, en cambio, está formado por un elemento muy electronegativo, el cloro, y uno muy poco electronegativo, el potasio. Esta combinación de elementos dará lugar a una red iónica formada por aniones Cl- y cationes K+, unidos fuertemente por atracción electrostática. Por este motivo, la temperatura requerida para separar los iones es muy alta y funde a 776ºC.
b) El fluoruro sódico, NaF, es un cristal iónico mientras que el flúor, F2, está formado por moléculas.
Aunque es similar al apartado a, la respuestas es un tanto distinta, ya que lo que debemos responder es por qué el fluoruro sódico es un cristal iónico y por qué el flúor es molecular. El fluoruro sódicos es un cristal iónico porque está formado por combinación de un elemento metálico, electropositivo, el sodio, y un elemento muy electronegativo, no metálico, el flúor. Esta combinación dará siempre lugar a un enlace de tipo iónico. En el caso de F2, los átomos son iguales y por este motivo la diferencia de electronegatividad del enlace es cero, por lo que formará un enlace covalente puro flúor-flúor que no puede dar lugar a ningún tipo de red, únicamente a moléculas aisladas.
c) La plata, Ag, conduce la corriente eléctrica y el cloruro de plata, AgCl, no.
La plata es un metal, que forma un empaquetamiento de cationes, mientras que los electrones tienen libertad y movilidad por todo el cristal, puesto que los orbitales atómicos de valencia de la plata dan lugar a orbitales “moleculares” pertenecientes a la totalidad del cristal, lo que se conoce como bandas. Esto hace que la plata pueda conducir la electricidad. En cambio, el AgCl es un compuesto iónico, formado por cationes Ag+ y Cl-. Los electrones se hallan localizados sobre los iones y no presentan movilidad, por lo que la red cristalina no puede conducir la electricidad en absoluto.
Enlace Químico Ejercicio 39: Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
En el siguiente ejercicio vamos a determinar la solubilidad de dos sólidos de naturaleza muy distinta, como son el yodo y el cloruro potásico, en dos disolventes también de naturaleza muy distinta, el agua y el tetracloruro de carbono. En concreto, el enunciado completo es:
¿En qué disolvente serán solubles los compuestos yodo y cloruro potásico? ¿En agua o en tetracloruro de carbono?
Para determinar la solubilidad vamos a recurrir a la siguiente regla nmemotécnica: “Semejante disuelve a semejante“. Esto significa que:
- Los disolventes polares disuelven bien a los solutos polares o cargados (iónicos).
- Los disolventes apolares disuelven bien a los solutos apolares.
Así, lo que debemos hacer en primer lugar debemos determinar el tipo de enlace o de fuerzas intermoleculares que mantienen unidos entre sí los distintos compuestos, tanto solutos como disolventes:
- Agua. Como hemos visto reiteradamente, el agua es una molécula de geometría angular, con enlaces polares, que es globalmente polar (los dipolos de sus enlaces H-O no se anulan por geometría) por lo que forma dipolos permanentes que se unen entre ellos por enlaces de hidrógeno. POLAR.

- Tetracloruro de carbono, CCl4. Aunque los enlaces C-Cl serán polares, ya que el cloro es más electronegativo que el carbono, la molécula tendrá una geometría tetraédrica (un átomo central rodeado de cuatro pares enlazantes), y los momentos dipolares de los cuatro enlaces se anularán entre sí, por lo que se trata de una molécula globalmente apolar por geometría. APOLAR.
- Yodo. También hemos visto en múltiples ejercicios previos el caso del yodo, que está formado por moléculas diatómicas de I2, totalmente apolares, ya que se trata de dos átomos idénticos. Esto hará que las únicas fuerzas intermoleculares que se puedan dar entre distintas moléculas de yodo sean dipolo instantáneo-dipolo inducido, es decir, fuerzas de dispersión o de London. APOLAR.

- Cloruro potásico. Puesto que está formado por la unión de un elemento muy electronegativo, el cloro, y de un elemento muy poco electronegativo, el potasio, esta unión dará lugar a un compuesto iónico, formado por cationes K+ y por aniones Cl-. Es, por tanto, una red cristalina formada por IONES (especies cargadas).
Una vez establecida dicha clasificación se puede deducir fácilmente, tal y como se explica en el tutorial, que el yodo será soluble en tetracloruro de carbono y no en agua, mientras que, por el contrario, el cloruro potásico será soluble en agua y no en tetracloruro de carbono.
También te puede interesar:
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Enlace Químico ejercicio 40: Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
En este ejercicio de enlace químico vamos a estudiar las propiedades de una serie de redes cristalinas a una temperatura de 0ºC. El enunciado es:
A l atemperatura de 0ºC, el cloruro de bario, el agua, el diamante y el yodo son sólidos, pero la naturaleza de sus redes cristalinas es muy distinta. ¿Qué tipos de redes forma cada uno de ellos?
Para determinar el tipo de enlace que se da entre los átomos de estos compuestos y a partir de esto el tipo de fuerzas intermoleculares debemos, como siempre, observar la diferencia de electronegatividad.
- Cloruro de bario. Se tratará de un compuesto iónico, ya que la diferencia de electronegatividad entre el bario y el cloro es mayor de 1,7. Así, tendremos una red cristalina formada por iones bario, Ba(2+), e iones cloruro, Cl-, en forma totalmente ordenada.
- Hielo. A 0ºC el agua es un sólido, el hielo. Se trata, como hemos visto reiteradamente, de una sustancia covalente polar, ya que la diferencia de electronegatividad del oxígeno y el hidrógeno es de 1,4, y esto hace que los enlaces sean muy polares. Además, dado que la geometría de la molécula de agua es angular, se tratará de una molécula globalmente muy polar porque los momentos dipolares de ambos enlaces H-O no se anulan por geometría. Esto hace que las moléculas de agua se unan entre sí por enlaces de hidrógeno, de forma ordenada y cristalina.

- Diamante. Se trata de una red covalente pura, formada únicamente por átomos de carbono. Se unirán, por tanto, a través de enlaces covalentes. En el diamante los carbonos presentan hibridación sp3, de forma que la disposición de los 4 pares electrónicos enlazantes en torno a cada carbono es tetraédrica. Así ocurre de forma sucesiva. Los enlaces covalentes son enlaces muy fuertes, y esto hace que el compuesto presente una gran dureza.
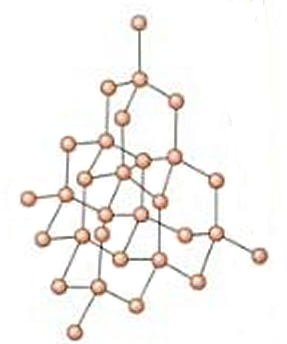
- Yodo. Hemos visto también en múltiples ejercicios previos el caso del yodo, que está formado por moléculas diatómicas de I2, totalmente apolares, ya que se trata de dos átomos idénticos. Esto hará que las únicas fuerzas intermoleculares que se puedan dar entre distintas moléculas de yodo sean dipolo instantáneo-dipolo inducido, es decir, fuerzas de dispersión o de London.

Enlace Químico ejercicio 41: Asignación de redes cristalinas: metal, compuesto iónico, red covalente o sólido molecular
En este ejercicio nos indican una serie de propiedades de ciertas sustancias, y en base a dichas propiedades debemos deducir de qué tipo de red cristalina se tratará: metal, compuesto iónico, red covalente o sólido molecular. Para ello, debemos recordar las propiedades de los metales, las propiedades de los compuestos iónicos y las propiedades de las sustancias covalentes, tanto de las redes covalentes como de las sustancias covalentes moleculares.
El enunciado es:
Teniendo en cuenta las propiedades que se indican, explica, razonándolo, el tipo de enlace en las redes cristalinas de las sustancias siguientes:
Sustancia A: es conductora de la electricidad tanto en estado sólido como fundido.
Sustancia B: sólido de elevado punto de fusión. conduce la corriente eléctrica fundido y en disolución acuosa, pero no en estado sólido.
Sustancia C: sólido de punto de fusión muy elevado. No conduce la corriente eléctrica ni en estado sólido ni fundido.
Sustancia D: su punto de fusión es muy bajo.
También te pueden interesar los siguientes ejercicios:
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
Enlace Químico ejercicio 42: Deducir de qué sustancia se trata en base a las propiedades
En este ejercicio de enlace químico vamos a asociar una serie de sustancias con ciertas propiedades físicas. El enunciado completo es:
De las sustancias siguientes: fluoruro de hidrógeno, sílice, metano, yodo, cloruro sódico, sodio y agua, asignar a cada una de las descripciones alguna de dichas sustancias:
- Sustancia soluble en agua que no conduce la corriente eléctrica en estado sólido.
- Sustancia que presenta enlaces de hidrógeno y funde por debajo de la temperatura ambiente.
- Sustancia molecular que presenta enlaces de hidrógeno, pero cuyos enlaces tienen más de un 50% de carácter iónico.
- Sustancia de elevada conductividad eléctrica que funde a una temperatura en torno a los 100ºC.
- Red covalente de elevado punto de fusión.
- Compuesto soluble en tetracloruro de carbono, CCl4, sólido a temperatura ambiente.
- Gas covalente formado por moléculas tetraédricas, CH4.
Para realizar el ejercicio, es importante recordar las propiedades de los compuestos iónicos, las propiedades de los metales, las propiedades de las redes covalentes y las propiedades de las sustancias covalentes moleculares.
También te puede interesar:
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
Asignación de redes cristalinas: metal, compuesto iónico, red covalente o sólido molecular
Enlace Químico ejercicio 43: Justificar los puntos de ebullición del etano, dimetiléter y etanol
En este ejercicio de enlace químico debemos justificar los distintos valores de puntos de ebullición del etano, CH3-CH3, del dimetiléter (o metoximetano), CH3-O-CH3, y del etanol, CH3-CH2-OH. En concreto, el enunciado es el siguiente:
Los puntos de ebullición del etano, del dimetiléter y del etanol son, respectivamente, -88ºC, -25ºC y 78ºC. Explica las razones de estas diferencias.
Para poder justificar las diferencias entre dichos puntos de ebullición debemos estudiar las estructuras de dichas moléculas y, a partir de ellas, determinar si existen o no enlaces polarizados y a qué tipo de fuerza intermolecular pueden dar lugar. Los puntos de ebullición más elevados, como el del etanol, corresponden a compuestos que pueden formar enlaces de hidrógeno.
También te puede interesar:
Propiedades de las redes cristalinas BaCl2, H2O, Diamante e I2
Cambios físicos: fundir cloruro potásico, hervir agua y disolver yodo en benceno
Propiedades físicas del cobre, el dióxido de carbono y el fluoruro de cesio
Razonar ciertos hechos experimentales, Cl2 y KCl, NaF y F2, Ag y AgCl
Solubilidad de yodo y cloruro potásico en agua y tetracloruro de carbono
Asignación de redes cristalinas: metal, compuesto iónico, red covalente o sólido molecular
Enlace Químico ejercicio 44: Puntos de ebullición de los compuestos de hidrógeno de halógenos y anfígenos
En este ejercicio de enlace químico debemos justificar los puntos de ebullición de los distintos compuestos que son combinación del hidrógeno con distintos halógenos (flúor, cloro, bromo y yodo) y con anfígenos (oxígeno, azufre, selenio y teluro). El enunciado es:
Los valores de lo puntos de ebullición de la combinación de hidrógeno con los halógenos y los anfígenos se muestra en la tabla siguiente:
HF = 19,5ºC; HCl = -85ºC; HBr = -67ºC; HI = -35ºC
H2O 100ºC; H2S = -60ºC; H2Se = -41ºC; H2Te = -1ºC
Explicar las razones de estas diferencias.
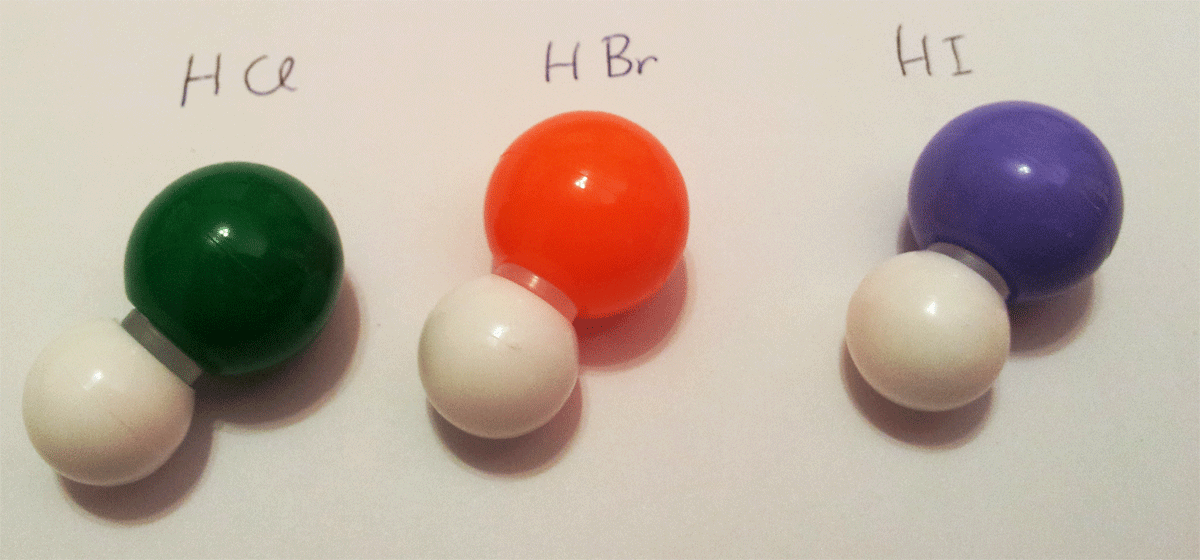
También te puede interesar:
Justificar los puntos de ebullición del etano, dimetiléter y etanol
Enlace Químico ejercicio 45: Ordenar por puntos de ebullición etanol, butano, agua y metano
En este ejercicio debemos deducir, considerando el tipo de fuerza intermolecular que presentan las sustancias consideradas, el orden decreciente de puntos de ebullición de cuatro sustancias, eligiendo entre cuatro opciones. El enunciado completo es:
Considerando la naturaleza de los enlaces intermoleculares que se establecen en cada caso, indicar cuál será el orden correcto, de mayor a menor, de los compuestos siguientes:
a) Etanol, H2O, metano, butano
b) H2O, etanol, butano, metano
c) Metano, H2O, butano, etanol
d) Metano, etanol, butano, H2O
Justificar la respuesta.
Atendiendo a las fuerzas intermoleculares, las opciones c y d se pueden descartar. Esto se debe a que el punto de ebullición del metano será el menor de todos los compuestos indicados, ya que se trata de una molécula tetraédrica apolar (se puede considerar que sus enlaces son levemente polares pero se anulan por geometría). Además, la masa molecular del metano es pequeña, y las fuerzas intermoleculares entre distintas moléculas de metano sólo podrán ser dipolo instantáneo – dipolo inducido o fuerzas de London. Estas serán las mismas fuerzas intermoleculares presentes entre distintas moléculas de butano, pero dado que éste tiene una mayor masa molecular, también será mayor su punto de ebullición. Eso nos hace descartar también la opción a, ya que en ésta se indica que el punto de ebullición del metano es superior al del butano, y acabamos de deducir que esto no es cierto. La única opción posible es la b, ya que en el etanol y en el agua, ambas moléculas polares con enlaces O-H, se darán enlaces de hidrógeno que harán que los puntos de ebullición de estas moléculas sean elevados, mucho más que en el caso del metano y del butano. Así, el orden de puntos de ebullición será:
Agua > Etanol > Butano > Metano
También te puede interesar:
Justificar los puntos de ebullición del etano, dimetiléter y etanol
Puntos de ebullición de los compuestos de hidrógeno de halógenos y anfígenos
Asignar puntos de fusión a nitrógeno, aluminio, diamante y tricloruro de boro