Aunque en la mayor parte del tema de termoquímica vamos a considerar las transferencias o variaciones de energía calorífica de una reacción química, en este apartado vamos a hablar de otro modo distinto de variación de energía, que es el trabajo mecánico de cambio de volumen (expansión o compresión) de un gas, ya que este concepto volverá a aparecer cuando hablemos del Primer Principio de la Termodinámica (apartado 5), que es parte esencial de este tema.
¿Qué es el trabajo de compresión o expansión de un gas?
El trabajo de cambio de volumen de un gas es el trabajo necesario para que el gas pase de un volumen inicial Vi a un volumen final Vf. Si el volumen disminuye, el gas se habrá comprimido y hablaremos de trabajo de compresión; si el volumen aumenta, el gas se habrá expandido y hablaremos de trabajo de expansión.
Para ilustrar mejor este trabajo de expansión o compresión de un gas, imaginemos un gas cerrado dentro de un recipiente, una de cuyas paredes es un émbolo móvil (como el de una jeringa) pero sin masa ni rozamiento. Si se produce una variación del volumen del recipiente, el émbolo se desplazará una distancia Δx, ya que en su expansión el gas empuja el pistón contra la presión externa, que permanece constante.
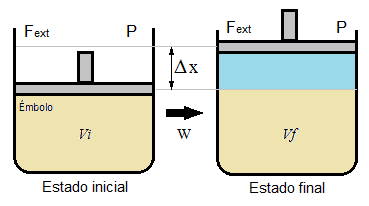
Puesto que el trabajo es es fuerza por desplazamiento, podemos escribir que:
W = -Fext·Δx
Y la fuerza es presión·superficie: Fext = P·S
W = -P·S·Δx
Mientras que la superficie por la variación de x que sufre el émbolo es la variación de volumen que experimenta el recipiente:
S·Δx = ΔV
De modo que finalmente el trabajo de expansión es:

Criterio de signos en el trabajo de compresión y expansión de un gas
Si aumenta el volumen, es el gas, es decir, el sistema, el que realiza un trabajo mecánico. Según el criterio de signo que adoptaremos, que es el establecido por la IUPAC, este trabajo realizado por el sistema se considera de signo negativo, es decir, W < 0.
Si disminuye el volumen, es el entorno el que ejerce un trabajo sobre el sistema, en cuyo caso, según el criterio de signos establecido por la IUPAC, consideraremos que le trabajo es positivo, W > 0.
NOTA: Es posible que en algunos textos se halle un criterio de signos distinto a este para el trabajo, considerándose que W = +P·ΔV y que por tanto W > 0 para el trabajo realizado por el sistema y W < 0 para le trabajo realizado sobre el sistema. Esto es habitual en tratados de física y de ingenierías, aunque para Química lo más habitual es considerar el criterio de signos expuesto aquí, que es el establecido por la IUPAC.
Ejemplo numérico simple de cálculo del trabajo de expansión de un gas
A continuación vamos a realizar un ejercicio numérico muy sencillo sobre le trabajo de expansión de un gas. El enunciado es:
Un gas se expande de un volumen inicial de 4 litros a un volumen de 9 litros, contra una presión externa constante de 2 atmósferas. Calcular el trabajo realizado por el sistema.