En el año 1864, Guldberg y Waage hallaron experimentalmente que existe una relación entre las concentraciones de reactivos y de productos de una reacción química una vez que esta ha alcanzado el equilibrio. A dicha relación se la denomina constante de equilibrio, y se simboliza como Kc. Veamos cómo deducir la expresión de Kc.
Si consideramos la siguiente reacción reversible:

La velocidad de la reacción hacia la derecha, de reactivos a productos, será:
vd = kd·[A]n·[B]m
Consideramos que se trata de un proceso elemental. Ya hemos indicado en numerosas ocasiones en el tema de cinética química, que si tenemos un proceso elemental, los exponentes de la ecuación de velocidad coinciden con los coeficientes estequiométricos, así:
vd = kd·[A]a·[B]b
Para la reacción inversa:
vi = ki·[C]c·[D]d
Al alcanzar el equilibrio, como hemos indicado en el primer apartado de teoría, lo que ocurre es que las velocidades directa e inversa se igualan:
vd = vi
kd·[A]a·[B]b = ki·[C]c·[D]d

El cociente entre las dos constantes de velocidad a una temperatura dada será otra constante, cuyo valor depende también de la temperatura, y que llamamos Kc, constante de equilibrio:
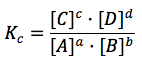
Esta expresión es la denominada ley de acción de masas. Así, la ley de acción de masas nos indica que, en un proceso elemental, el producto de las concentraciones de los productos en el equilibrio, elevadas a sus respectivos coeficientes estequiométricos, dividido por el producto de las concentraciones de los reactivos elevadas a sus respectivos coeficientes estequiométricos, es un valor constante para cada temperatura.
Aunque el valor de la constante de equilibrio Kc está asociado a concentraciones molares, por convenido se suele expresar como una magnitud adimensional, esto es, sin unidades.
Por ejemplo, para la reacción entre I2 y H2 para dar HI:
I2(g) + H2(g) ⇔ 2HI(g)

Kc a 298K = 794
Kc a 500K = 160
Kc a 1100K = 25
Aunque como vemos el valor de la constante de equilibrio Kc varía con la temperatura, su valor es independiente de las concentraciones iniciales de reactivos y productos.
El valor de Kc de una reacción química nos indica en qué grado se produce la misma. Así:
- Cuando Kc > 1, la mayoría de reactivos se convierten en productos cuando se alcanza el equilibrio químico.
- Cuando Kc ≈ ∞, prácticamente no existen más que productos, se comporta como una reacción irreversible.
- Cuando Kc < 1, al alcanzarse el equilibrio químico, solo se han formado pequeñas concentraciones de productos, la cantidad de reactivos es mayor.
Por ejemplo, para las reacciones siguientes, todas ellas a 500K:
N2O2(g) ⇔ 2NO2(g) Kc = 42, la [NO2] es mayor que la [N2O2]
F2(g) ⇔ 2F(g) Kc = 7,3·10-13, la reacción prácticamente no se da
H2(g) + Cl2(g) ⇔ 2HCl(g) Kc = 4·1018, la reacción es prácticamente completa, no quedarán en el recipiente moléculas de reactivos, H2 y Cl2.
Cabe destacar también que el valor de la constante de equilibrio Kc corresponde a un equilibrio expresado de forma determinada, de manera que si varía el sentido de la reacción, o su ajuste estequiométrico, también lo hace el valor de la constante, aunque ambos valores presentan cierta relación. Así:
- La constante de equilibrio de una reacción y su inversa son recíprocas:
I2(g) + H2(g) ⇔ 2HI(g) Kc
2HI(g) ⇔ I2(g) + H2(g) Kc‘

- Si una reacción ajustada se multiplica o divide por un valor n (es decir, se ajusta de forma distinta), la constante de equilibrio sufre el mismo cambio, aunque como exponente:
Ecuación 1: I2(g) + H2(g) ⇔ 2HI(g) Kc
Ecuación 2: (1/2)I2(g) + (1/2)H2(g) ⇔ HI(g) Kc‘
Ecuación 2 = (1/2)·Ecuación 1
Kc‘ = (Kc)1/2

- Si un proceso es la suma de varios equilibrios químicos, la constante de equilibrio global es producto de las anteriores:
H2(g) + 1/2O2(g) ⇔ H2O(g) Kc
CO2(g) ⇔ CO(g) + 1/2O2(g) Kc‘
H2(g) + CO2(g) ⇔ CO(g) + H2O(g) Kc”

Por último, cabe destacar que cuando tenemos equilibrios heterogéneos, las concentraciones de sólidos o de líquidos puros no se indican en la expresión de la constante de equilibrio Kc porque son constantes y se incluyen en la misma. Únicamente se tienen en cuenta las especies disueltas o en estado gas:
CaCO3(s) ⇔ CaO(s) + CO2(g)
Así, para esta reacción, como CaCO3 y CaO son sólidos no se incluyen en la expresión de la constante, y esta queda únicamente como Kc = [CO2], incluyendo únicamente el CO2 por ser la única especie gaseosa.
También te puede interesar: