En este ejercicio del tema de cinética química, calcularemos la energía de activación de una reacción a partir de la relación entre las constantes de velocidad a dos temperaturas distintas. El enunciado completo es el siguiente:
La velocidad de una reacción química se multiplica por 4 cuando pasamos de 290 a 312K. ¿Cuál es su energía de activación?
Para poder realizar este cálculo haremos uso de la ecuación de Arrhenius linealizada:
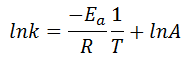
También te puede interesar:
Cinética Química Teoría 8: Ecuación de Arrhenius
Cinética Química Ejercicio 16: Calcular la constante de velocidad con la ecuación de Arrhenius