En este ejercicio de enlace químico vamos a determinar la estructura de Lewis de la molécula de fosgeno, COCl2, así como la hibridación que presenta el átomo central y a estudiar algunos parámetros de enlace, como por ejemplo la distancia de enlace y el ángulo.
El enunciado es:
El fosgeno, COCl2, es un gas tóxico usado en múltiples aplicaciones industriales, que también se usó como arma química en la Primera Guerra Mundial. ¿Qué hibridación presentará el átomo central y qué geometría? ¿Serán las distancias y ángulos de enlace iguales en todos los casos?
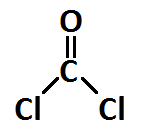
En el caso de las distancias de enlace, serán distintas porque un enlace doble será más corto, en general, que un enlace simple. Además, el oxígeno es un átomo menos voluminoso que el cloro, por lo que incluso el enlace simple C-O será más corto que el enlace C-Cl, cuando más el doble enlace C=O.
En cuanto a los ángulos de enlace, la densidad electrónica del doble enlace C=O es mayor que la de los enlaces C-Cl, esto hará que ejerza una mayor repulsión este enlace sobre los vecinos, por lo que dichos enlaces C-Cl se cerrarán más y este ángulo, en lugar de los 120º esperables por la hibridación sp2 del carbono y la geometría plana trigonal, es de 112º.
También te puede interesar:
Determinar la geometría de algunas moléculas por RPECV e hibridación
Determinar el tipo de hibridación de los átomos de una molécula orgánica