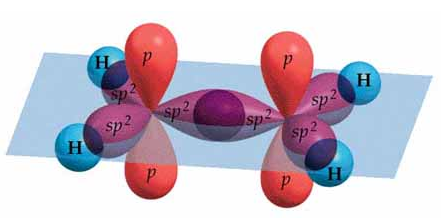
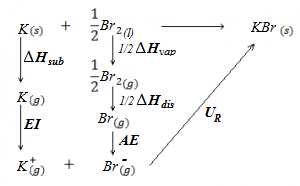
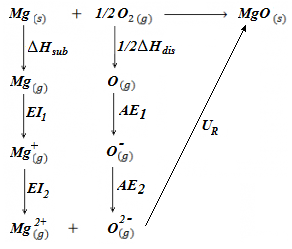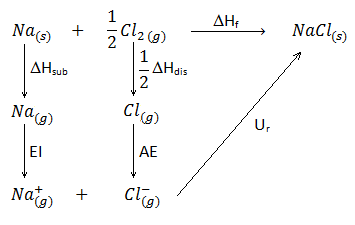En este ejercicio vamos a determinar qué tipo de hibridación presentan los átomos de una molécula orgánica (a excepción de los hidrógenos, que evidentemente no presentan ningún tipo de hibridación porque únicamente disponen de un electrón en el orbital 1s). Para ello debemos observar el número de electrones que tendrá cada átomo en la capa de valencia (3 en el caso del boro, 4 en el caso del carbono) y de qué modo se han de distribuir o desaparear estos electrones para formar el número de enlaces observados. Asimismo, la presencia de dobles o triples enlaces en las uniones carbono-carbono nos indicará también el tipo de hibridación:
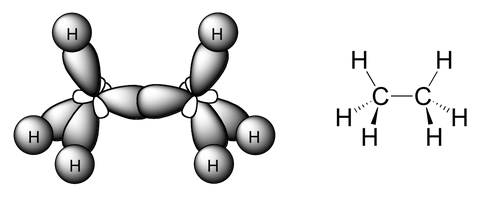
- Carbono que forma 4 enlaces simples: hibridación sp3, tetraédrica
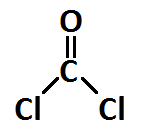
- Carbono que forma 2 enlaces simples y 1 enlace doble: hibridación sp2, trigonal plana
- Carbono que forma 1 enlace simple y 1 enlace triple, o 2 enlaces dobles: hibridación sp, lineal
El enunciado completo es el siguiente:
Indicar el tipo de hibridación de los átomos de la molécula siguiente, sabiendo que el número atómico del carbono es 6 y el del boro 5: