Cuando la química llevaba poco tiempo haciendo sus primeros pinitos como ciencia (y no como alquimia), a mediados del siglo XVII, los gases suscitaron un gran interés por parte de algunos científicos hoy en día célebres. Así, del estudio de estos, surgieron algunas leyes de su comportamiento que conocemos como leyes de los gases. La primera de estas leyes que vamos a considerar es la ley de Boyle-Mariotte, que recibe este nombre porque fue enunciada por separado por dos científicos, Robert Boyle, en 1662, y Edme Mariotte, en 1676. Catorce años pueden parecer una diferencia tan grande que no se entienda el porqué de “Mariotte” en el nombre de la ley (y de hecho muchas veces es nombrada simplemente como ley de Boyle), pero debemos tener en cuenta que las comunicaciones por entonces no eran lo que son hoy en día, y menos de veinte años en un descubrimiento científico no era tanto como parece.
También trataremos en posteriores entradas otras leyes de los gases, como la ley de Gay-Lussac y la ley de Charles, todas ellas relacionadas. Los leyes que cumplen estas leyes reciben el nombre de gases ideales. Son gases ideales, por ejemplo, el dihidrógeno (H2), el oxígeno (O2) o el dióxido de carbono (CO2).
Así, para estudiar los gases, como el aire o el dióxido de carbono, se deben tener en cuenta tres variables de estado: la temperatura, la presión y el volumen.
Las unidades de temperatura en el SI* son los kelvin (K), aunque también se mide en grados centígrados (°C).
Las unidades de presión en el SI son los pascales (Pa), aunque también se mide en atmósferas (atm) y en milímetros de mercurio (mm Hg)
Las unidades del volumen en el SI son los metros cúbicos (m3), aunque también se mide en litros (L).
*SI: Sistema Internacional de unidades
Lo que estudiaron Robert Boyle y Edmé Mariotte para enunciar su ley fue cómo varía la presión de un gas al modificar el volumen, manteniendo constante la temperatura. Boyle elaboró de este modo una tabla de este estilo para un valor dado de temperatura constante:
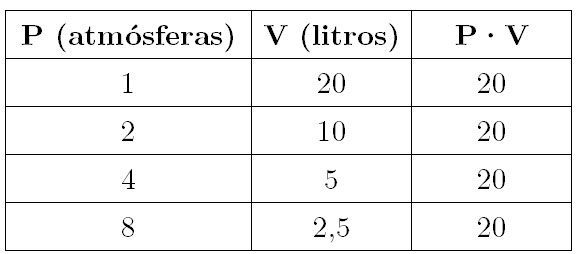
Analizando los datos de la tabla queda patente que la presión y el volumen son magnitudes inversamente proporcionales; el producto P·V permanece constante a una misma temperatura. Así, si duplicamos la presión, el volumen se va reduciendo a la mitad, por lo que tenemos un volumen de 20 litros a 1 atmósfera de presión, pero éste solo es de 10 litros si estamos al doble, 2 atmósferas de presión.
Por tanto, la ley de Boyle-Mariotte establece que, cuando un gas experimenta una transformación a temperatura constante, el producto de la presión ejercida por el volumen ocupado permanece constante, es decir:

Si tenemos un gas en un émbolo en un estado 1, y la temperatura permanece constante cuando pasa a un estado 2, la presión y el volumen son inversamente proporcionales, es decir, si la presión aumenta disminuye el volumen y viceversa.
Es lógico si tenemos en cuenta que al aumentar la presión las partículas del gas se hallan más juntas, más comprimidas, y por tanto ocupan un volumen menor.
En entradas posteriores hablaremos de las restantes leyes de los gases, así como de la ecuación general de los gases ideales, que combina las tres primeras leyes.