En 1935, Henry Eyring y sus colaboradores elaboraron la Teoría del Complejo Activado o Teoría del Estado de transición para explicar a nivel molecular cómo transcurren las reacciones químicas. En dicha teoría se postula que cuando las moléculas de los reactivos se aproximan, experimentan una deformación y dan lugar a un estado intermedio transitorio, denominado Estado de Transición. Dicho Estado de Transición es de muy alta energía y muy corta duración, y en el mismo se forma una estructura transitoria de máxima energía que se denomina Complejo Activado (formado por todos los átomos implicados en la reacción).
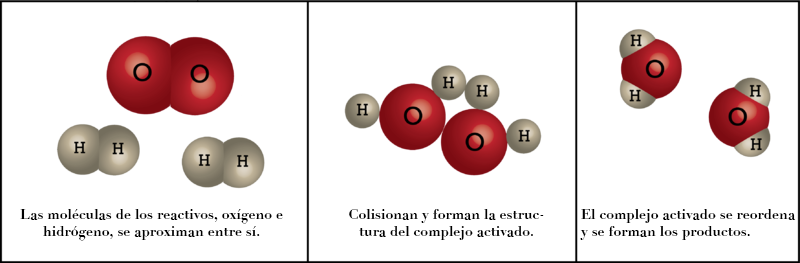
Para que se forme el Complejo Activado, es necesaria una cierta cantidad de energía, denominada Energía de Activación. Es decir, se puede decir que:
La Energía de Activación es la energía necesaria para que se forme el complejo activado.
Para el estudio energético del Estado de Transición y de la Energía de Activación es muy útil el uso de diagramas energéticos o diagramas entálpicos vistos en el tema de termoquímica.
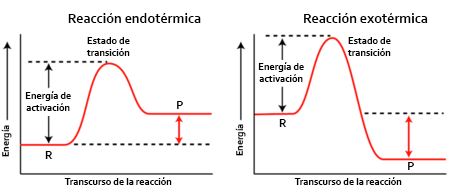
Si los recordamos, en dichos diagramas dibujamos una montaña en el transcurso de la reacción correspondiente a un máximo de energía. Este máximo de energía es el Estado de Transición. La Energía de Activación es la diferencia entre la energía de los reactivos y la energía del Complejo Activado, es decir, la subida de la montaña.
Esta Energía de Activación se relaciona directamente con la velocidad de una reacción química. Cuanto más pequeña sea le energía de activación, más rápida será la reacción química (mayor velocidad de reacción) porque más fácilmente alcanzarán los reactivos al chocar la energía del Estado de Transición y formarán el Complejo Activado. Es decir, el Estado de Transición será más asequible o fácil de alcanzar.
También te puede interesar: