En este ejercicio vamos a calcular la entalpía del enlace carbono-carbono a partir de la entalpía de hidrogenación de un compuesto orgánico insaturado, el más simple de los alquenos, el eteno. La reacción de hidrogenación consiste en la adición de dos átomos de hidrógeno al doble enlace para formar un enlace simple. Así, la hidrogenación del eteno produce etano, el alcano de dos átomos de carbono. Para el cálculo de dicha entalpía o energía de enlace disponemos de las energías de los restantes enlaces implicados y la entalpía de la reacción de hidrogenación, de forma que el cálculo de la entalpía se realizará en base a la energía de enlaces rotos y enlaces formados, como se ha explicado ya en un vídeo teórico. Es decir, la fórmula de aplicación es la siguiente:
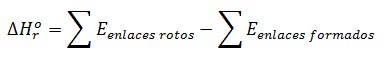
El enunciado completo del ejercicio es:
La entalpía de hidrogenación del etileno para formar etano es de -131 kJ. Calcular la energía del enlace C-C si las energías de los enlaces C=C, C-H e H-H son de 610 kJ/mol, 415 kJ/mol y 436 kJ/mol respectivamente.

Tal vez también te interese: